Кардиология №11 / 2016
Иммунологический анализ атеросклеротических бляшек человека в системе культивирования ex vivo
1Лаборатория атеротромбоза ФГБОУ ВО Московский государственный медико-стоматологический университет им. А.И. Евдокимова Минздрава, РФ, Москва; 2Отделение сосудистой хирургии ФГБУ Институт хирургии им. А.В. Вишневского Минздрава РФ, Москва; 3Отдел межклеточных взаимодействий Национального Института Детского Здоровья и Развития Человека им. Юнис Кеннеди Шрайвер Национальных Институтов Здоровья, Мэриленд, США
Атеросклеротическое поражение артерий — одна из основных причин смертности в развитых странах. Долгое время в литературе атеросклероз описывался только как следствие нарушенного липидного обмена в ткани. Однако в дальнейшем было обнаружено, что в развитии атеросклероза большую роль играют и другие факторы риска, такие как возраст, артериальная гипертензия, сахарный диабет, курение [1]. Кроме того, многие работы указывают на важную роль воспаления в развитии данной патологии [2]. В ряде иммуногистохимических исследований показано, что в атеросклеротических бляшках (АСБ) содержатся клетки врожденного и адаптивного иммунитета: макрофаги, Т- и В-клетки [3—7]. Участие клеток адаптивного иммунитета в атерогенезе показано на экспериментальных моделях: у мышей без адаптивного иммунитета отмечалось развитие АСБ меньших размеров, чем у мышей дикого типа [8, 9]. Роль адаптивного иммунитета в развитии атеросклероза также подтверждена по косвенным данным. Так, L. Johnasson и соавт. в АСБ человека выявили гладкомышечные клетки, экспрессирующие типичные для антигенпрезентирующих клеток поверхностные молекулы главного комплекса гистосовместимости II (MHC II) [10]. Доказательством участия В-лимфоцитов в атерогенезе послужило обнаружение в АСБ аутологичных антител против окисленных липопротеидов низкой плотности (ЛНП) [11, 12]. Кроме того, экспериментально показана роль костимуляторных молекул Т-лимфоцитов в атерогенезе [13]. В нашей предыдущей работе мы подтвердили участие иммунной системы в атерогенезе, показав, что в АСБ человека Т-лимфоциты находятся в значительно более активированном состоянии, чем в крови тех же пациентов [14]. Возможно, что именно Т-клеткам может принадлежать ведущая роль в активации воспаления при прогрессировании атеросклероза [15].
Таким образом, накоплено значительное количество данных об участии иммунной системы в атерогенезе. Однако большая часть упомянутых экспериментальных исследований проводилась на монослойных культурах клеток, которые не воссоздают микроокружения, типичного для АСБ in vivo [16, 17]. Некоторые исследования проведены также на модельных животных, в частности на мышах, нокаутных по генам аполипопротеинов или рецептора к ЛНП, структура АСБ которых значительно отличается от АСБ человека [18]. В связи с перечисленными недостатками описанных моделей остается открытым вопрос о соответствии полученных на них данных процессам, происходящим в организме человека при атеросклерозе. Необходима разработка более адекватной лабораторной модели, в которой контролируемость внешних параметров сочеталась бы с воспроизведением структуры и микроокружения АСБ, включая разветвленную сеть межклеточных взаимодействий эндотелия и гладкомышечных клеток с клетками иммунной системы. В предыдущей работе на основании методики J.-C. Grivel и L.B. Margolis [19] нами был разработан способ культивирования эксплантов АСБ человека, при котором жизнеспособность и структура ткани сохраняются в течение 20—22 дней [20]. Однако резекция тканей человека является крайне травматичным процессом; более того, при культивировании АСБ помещаются в условия in vitro, что может приводить к изменению фенотипов иммунных клеток в АСБ и их последующей гибели. Таким образом, для изучения роли иммунной системы в атерогенезе в составе АСБ человека необходимо подтверждение жизнеспособности и стабильности фенотипа основных субпопуляций иммунных клеток в тканевой культуре, сохраняющей систему типичных для АСБ межклеточных взаимодействий. В связи с этим целью настоящей работы стало исследование динамики лимфоцитарного состава АСБ в разработанной нами ранее системе ex vivo.
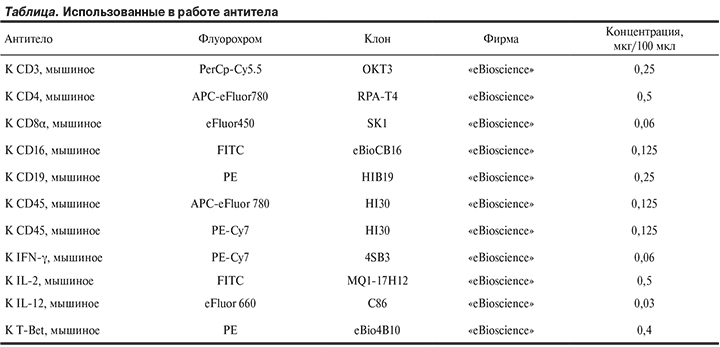
Материал и методы
Пациенты. Мы проанализировали 15 АСБ человека, полученных в результате операции каротидной эндатерэктомии в Институте хирургии им. А.В. Вишневского. Среди пациентов было 66,7% мужчин и 33,3% женщин, средний возраст пациентов составил 66,6±8,1 года. Все пациенты подписали информированное согласие для использования операционного материала в данном исследовании.
Культура ткани. АСБ были доставлены в лабораторию в стерильной среде RPMI 1640 Advanced с добавлением раствора антибиотика/антимикотика (в итоговой концентрации 100 ед/мл пенициллина, 100 мг/мл стрептомицина, 0,25 мг/мл амфотерицина B). Подготовку материала осуществляли не позже чем через 2 ч после операции. Культивирование АСБ проводили по разработанной ранее методике [20]. В стерильных условиях пригодные для культивирования участки АСБ (без ярко выраженной кальцификации или атероматоза) были разрезаны перпендикулярно длине сосуда на кольцевидные блоки толщиной 2 мм.

Ткань культивировали на коллагеновых губках в 35-миллиметровых чашках Петри с 3 мл культивационной среды RPMI 1640 Advanced с добавлением 100 мк...












