Кардиология №5 / 2016
Инфаркт миокарда и естественные механизмы защиты: роль обратного захвата норадреналина
ФГБНУ НИИ физиологии и фундаметальной медицины, Новосибирск
Цель исследования: изучить влияние блокады обратного захвата норадреналина в реперфузионном периоде на величину инфаркта при локальной ишемии миокарда в условиях ишемического пре- и посткондиционирования. Крыс Вистар (n=46) случайным образом разделили на 6 групп. В 1-й группе (n=7) осуществляли 30-минутную окклюзию левой коронарной артерии и 120-минутную реперфузию; во 2-й группе (n=7) — то же, что и в 1-й +дезипрамин (0,8 мг/кг внутривенно) в начале реперфузии. В 3-й группе (n=6) перед окклюзией осуществляли ишемическое прекондиционирование (трижды по 3 мин ишемии+3 раза×3 мин реперфузии);
в 4-й группе (n=7) то же, что и в 3-й +дезипрамин (0,8 мг/кг внутривенно) в начале реперфузии. В 5-й группе (n=9) после окклюзии обеспечивали ишемическое посткондиционирование (6 раз по 10 с окклюзии+6 раз по 10 с реперфузии); в 6-й группе (n=10) — то же, что и в 5-й +дезипрамин (0,8 мг/кг внутривенно) в начале реперфузии. В 1-й, 3 и 5-й группах в начале реперфузии вводили 1 мл раствора Рингера внутривенно. Статистическая обработка результатов с помощью критерия Манна—Уитни. В 1-й группе размер зоны инфаркта миокарда составил 32,0±3,1% зоны риска, во 2-й — 46,1±3,4% (р=0,006); в 3-й — 15,3±3,1% (р=0,008 при сравнении с 1-й группой), в 4-й — 44,7±4,7% (р=0,0027 при сравнении с 3-й группой), в 5-й — 22,2±2,6% (р=0,028 при сравнении с 1-й группой), в 6-й — 50,3±3,1% (р=0,018 и p>0,05 по сравнению с 5-й и 2-й группами соответственно). Таким образом, блокада обратного захвата норадреналина в раннем реперфузионном периоде приводит к увеличению повреждения миокарда, а также препятствует защитному действию ишемического пре- и посткондиционирования.
Несмотря на значительный прогресс в области экспериментальных и клинических исследований, проблема развития острого инфаркта миокарда (ИМ) продолжает оставаться актуальной. Известно, что тяжесть повреждения миокарда при его ишемии зависит, в том числе от степени накопления норадреналина в интерстициальном пространстве миокарда [1]. Одной из причин выраженного повышения уровня норадреналина в интерстициальном пространстве миокарда является реверсия в условиях ишемии нормального механизма его обратного захвата. Показано, что в условиях ишемии белок (транспортер норадреналина) не захватывает норадреналин, выделившийся в интерстициальное пространство, а активно эвакуирует его из симпатических нервных окончаний [2].
Попытка предотвратить накопление норадреналина в интерстициальном пространстве с помощью блокатора его обратного захвата до начала ишемии оказалась успешной, и величина инфаркта уменьшалась [3]. Однако до настоящего времени остается неясным, как будет влиять на величину ИМ блокада обратного захвата норадреналина (ОЗН) в период реперфузии, когда восстанавливается нормальное функционирование механизма обратного захвата норадреналина.
Цель исследования: изучить влияние блокады ОЗН в реперфузионном периоде на величину инфаркта при локальной ишемии миокарда в условиях ишемического пре- и посткондиционирования.
Материал и методы
Работа выполнена на 46 крысах-самцах Вистар со средней массой тела 355,2±14,8 г, содержавшихся в обычных условиях вивария. Эксперименты проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. №755).
Животным под уретановым наркозом (2,1±0,07 мг/кг внутрибрюшинно) выполняли трахеотомию. Искусственную вентиляцию легких осуществляли при помощи аппарата Model 683 («Harvard Apparatus», США) смесью воздуха с 20% кислорода. В течение эксперимента контролировали электрокардиограмму. Температуру тела крысы, измеряемую в прямой кишке, поддерживали путем подогрева операционного стола. Левостороннюю торакотомию выполняли в пятом межреберье. После рассечения перикарда с помощью нейлоновой нити формировали петлю вокруг левой коронарной артерии на расстоянии 1—2 мм ниже ушка левого предсердия. Оба конца петли вводили в отверстия пластикового окклюдера.
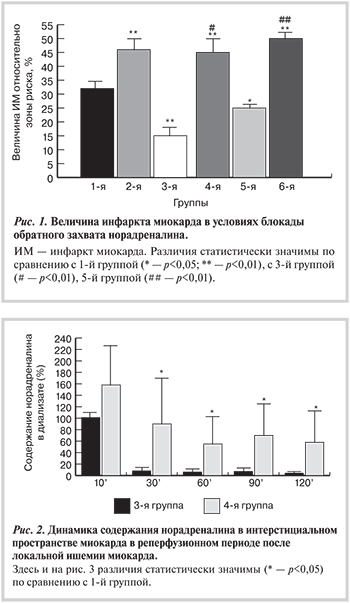 Протокол эксперимента. Животные были случайным образом разделены на 6 групп. В 1-й группе (n=7) осуществляли окклюзию (30 мин) и реперфузию (120 мин). В начале реперфузии вводили 1 мл раствора Рингера внутривенно.
Протокол эксперимента. Животные были случайным образом разделены на 6 групп. В 1-й группе (n=7) осуществляли окклюзию (30 мин) и реперфузию (120 мин). В начале реперфузии вводили 1 мл раствора Рингера внутривенно.
Во 2-й группе (n=7) выполняли то же, что и в 1-й, но в начале реперфузии животным вводили дезипрамин (0,8 мг/кг) — неселективный ингибитор обратного захвата норадреналина.
В 3-й группе (n=6) выполняли ишемическое прекондиционирование тремя 3-минутными окклюзиями, разделенными 3-минутными периодами реперфузии. После этого осуществляли окклюзию (30 мин) и реперфузию (120 мин). В начале реперфузии вводили 1 мл раствора Рингера внутривенно.
В 4-й группе (n=7) выполняли то же, что и в 3-й, но в начале реперфузии животным вводили дезипрамин (0,8 мг/кг).
В 5-й группе (n=9) через 10 с после 30-минутной окклюзии выполняли ишемическое посткондиционирование шестью 10-секундными окклюзиями, разделенными 10-секундными периодами реперфузии. Затем следовала реперфузия (120 мин). В начале реперфузии вводили 1 мл раствора Рингера внутривенно.
В 6-й группе (n=10) выполняли то же, что и в 3-й, но в начале реперфузии животным вводили дезипрамин (0,8 мг/кг).
Микродиализ. В 1—4-й группах в зону ишемии, которая обнаруживалась по обесцвечиванию ткани миокарда при кратковременном затягивании нитей окклюдера, вживляли диализный зонд. В экспериментах использовали линейные микродиализные зонды на базе полиакрилнитриловой мембраны («CGH Medical Inc.», «Lakewood», США) длиной 6 мм с внешним диаметром около 300 мкм и критической массой пропускания 29 000 дальтон. С обеих сторон к мембране приклеивали входной и выходной полиимидные капилляры с внутренним диаметром ок...












