Фарматека №2 (315) / 2016
Инфекция Helicobacter pylori и хроническая железодефицитная анемия: особенности сочетанного течения и терапии
ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, Москва
Введение
Инфекция Helicobacter pylori (H. pylori) является одной из самых распространенных среди людей. В индустриально развитых странах от 20 до 50% взрослого населения инфицированы данным микроорганизмом. В свою очередь в развивающихся странах показатель инфицированности превышает 80% [1, 2]. В настоящий момент данная инфекция рассматривается как важный этиопатогенетический компонент ряда заболеваний гастродуоденальной зоны (хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, аденокарцинома и MALT-лимфома желудка) [1, 3]. Однако за последнее время появляется все больше исследований, демонстрирующих возможную прямую или опосредованную связь между H. pylori и возможностью формирования ряда внегастральных заболеваний.
С позиций доказательной медицины накапливаются данные об ассоциации инфекции H. pylori с идиопатической железодефицитной анемией (ЖДА) и идиопатической тромбоцитопенической пурпурой [4]. Не случайно, согласно рекомендациям Маастрихта-4, показано проведение эрадикационной терапии (ЭТ) всем пациентам, страдающим хронической ЖДА неясной этиологии, после получения от них положительных результатов тестов на H. pylori (уровень доказательности: 1а; класс рекомендаций: А) [5, 6].
ЖДА – не только широко распространенное во всем мире состояние, но и серьезный фактор риска развития дополнительных осложнений со стороны различных органов и систем, в первую очередь со стороны ЖКТ. При этом нередко ЖДА рассматривают как вторичный симптом, осложняющий клиническую картину и диагностику, не уделяют должного внимания, а порой и совершенно упускают из виду [7]. В целом, по данным Всемирной организации здравоохранения, во всем мире сегодня насчитывается 1,6 млрд больных ЖДА и 3,6 млрд пациентов со скрытым дефицитом железа [8], что в свою очередь подчеркивает важное медико-социальное значение своевременной диагностики и лечения.
К настоящему времени было продемонстрировано, что у H. pylori-позитивных больных имеется более низкий уровень сывороточного ферритина и железа по сравнению с H. pylori-негативными больными [9], причем у больных с атрофическим гастритом, ассоциированным с H. pylori-инфекцией, данные показатели «железного» статуса бывают наиболее низкими [10]. H. pylori представляет собой вирулентный агент, который поглощает и использует для своей жизнедеятельности значительное количество железа [10]. Так же как и другие грамотрицательные бактерии, этот микроорганизм вступает в сложные конкурентные взаимоотношения за железо. С этой целью им используется синтезируемый сидерофор фенолятного или гидроксоматного типа, который в дальнейшем соединяется с ферратом сидерофилов с последующей экстракцией железа с поверхности клеток. Возможен непосредственный лизис клеток под воздействием продуцируемых H. pylori уреазы и муциназы с извлечением железа макроорганизма (человека), переваривания гемоглобина и усвоения (ассимилирования) гема с образованием сидерофор, позволяющих извлекать железо макроорганизма [11]. Наличие на слизистой оболочке желудка H. pylori способствует развитию ЖДА у взрослых и детей [12]. Наличие H. pylori-инфекции в сочетании с ЖДА чаще сопровождается поражением всей слизистой оболочки желудка и развитием пангастрита [10]. Проводимая пероральная ферротерапия восстанавливает и поддерживает нормальный уровень железа, однако после ее прекращения анемия вновь возвращается.
В целом механизмы взаимоотношения ЖДА и инфекции H. pylori во многом остаются еще не ясными. В частности, по-прежнему открыт вопрос: почему среди пациентов, страдающих от H. pylori-инфекции, ЖДА выявляется далеко не у всех? Ряд исследователей предполагают, что для роста и пролиферации H. pylori требуется железо организма хозяина, а некоторые штаммы обладают специфической особенностью нарушать метаболизм железа путем связывания его со своей наружной мембраной [13]. При этом, по данным исследователей, штаммы CagA, а также возможные мутации в бактериальных генах служат фактором вирулентности в плане поглощения железа. Инфицирование CagA штаммами ведет к более выраженным атрофическим изменениям слизистой оболочки желудка (СОЖ), сопровождающимся снижением секреции желудочного сока и повышением внутрижелудочной pH, а также концентрации гастрина в сыворотке [14]. Противоречивость данных, которая присутствует в ряде работ по изучению эффективности терапии ЖДА у пациентов с H. pylori, может быть связана прежде всего с неоднородностью географической распространенности и различности в штаммах инфекта. Так, данные одного из последних мета-анализов показывают большую эффективность и оправданность проведения предварительной ЭТ и последующего лечения препаратами железа пациентов Азиатско-Тихоокеанского региона, чем пациентов стран Северной Америки [15].
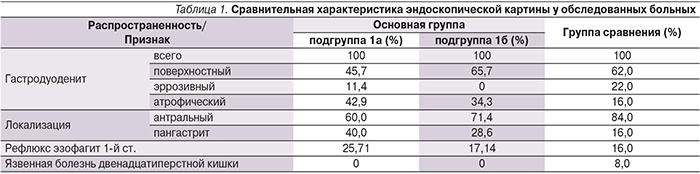
Вышеперечисленные данные безусловно делают актуальным вопрос комплексного изучения ассоциаций инфекции Н. pylori и ЖДА как на патогенет...












