Клиническая Нефрология №2 / 2016
Использование различных формул расчета скорости клубочковой фильтрации у больных сахарным диабетом 1 типа
ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» МЗ РФ, Санкт-Петербург
Цель исследования. Сопоставление различных способов оценки СКФ, рассчитанных по креатинину и цистатину С у больных СД 1 типа (СД1) c нормальной и умеренно сниженной фильтрационной функциями почек.
Материал и методы. Обследованы 57 больных СД1, 37 мужчин и 20 женщин от 21 года до 57 лет (медиана – 30 лет) с длительностью заболевания с момента постановки диагноза от 33 до 2 лет (медиана – 8 лет). Контрольную группу составили 15 человек в возрасте от 19 до 42 лет (медиана – 28 лет) без СД, с нормоальбуминурией и нормальным уровнем креатинина в крови. У большинства больных СД1 выявлена декомпенсация углеводного обмена. Средние значения гликированного гемоглобина у пациентов составили 8%. Состояние гломерулярной функции почек изучали по уровню СКФ в трехкратном исследовании экскреции альбумина с мочой. Состояние канальцевой функции почек при СД1 изучали с помощью исследования сывороточного уровня цистатина С.
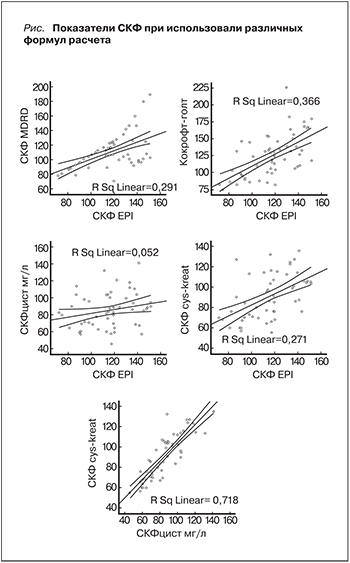
Результаты. Формулы расчета СКФ, в которых не учитывался сывороточный уровень цистатина С, давали более высокие значения СКФ, в результате большинство пациентов имели нормальные или повышенные цифры СКФ, свидетельствовавшие о гиперфильтрации. При использовании формул с цистатином С число больных с гиперфильтрацией снижалось в несколько раз и увеличивались случаи СКФ ниже 90 мл/мин/м2. При оценке взаимосвязи СДМА и СКФ диагностирована отрицательная корреляция с формулой, учитывавшей как цистатин С, так и креатинин.
Заключение. Согласно полученным данным, формула СКФ, которая включает для расчета показатели креатинина и цистатина С, дает более точные результаты по сравнению с референсными методами оценки.
Введение
Диабетическая нефропатия (ДН) и развившаяся вследствие нее терминальная стадия хронической почечной недостаточности являются одними из наиболее частых причин смерти больных сахарным диабетом 1 типа (СД1). Сложность патогенеза, длительное бессимптомное течение и несвоевременная диагностика приводят к неудовлетворительной эффективности патогенетической терапии ДН. Данные эпидемиологического скрининга в разных регионах России свидетельствуют, что истинная распространенность ДН превышает фактическую в 2–4 раза [1]. В первые 5 лет от дебюта СД развиваются функциональные и структурные изменения почек. К наиболее ранним морфологическим признакам нефропатии относятся гипертрофия клубочков, пролиферация мезангиальных клеток и утолщение стенок капиллярных петель, затем развиваются дистрофические и атрофические изменения канальцев, фиброз интерстиция артерий и артериол [2, 3].
 Наличие увеличения экскреции альбумина с мочой не всегда свидетельствует о неблагоприятном прогнозе в отношении почечной функции, более того, данное состояние оказывается обратимым и в то же время появляются выборки больных с прогрессирующим снижением скорости клубочковой фильтрации (СКФ) без наличия увеличения экскреции альбумина с мочой. Длительное наблюдение P. Fioretto и соавт. за пациентами с ДН после трансплантации поджелудочной железы показало, что через 10 лет при полном устранении гипергликемии наблюдается регресс структурных изменений ткани почек у больных СД 1 типа (СД1) [4–6]. Стойкая нормализация углеводного обмена, а также назначение своевременной терапии для купирования внутриклубочковой гипертензии могут остановить патологический процесс в почках на ранних стадиях. Таким образом, продолжение поиска ранних критериев поражения почек у больных СД остается весьма актуальной проблемой. Что такое ранняя диагностика ДН? Считается ли увеличение экскреции альбумина (ЭАМ) с мочой более 300 мг/сут своевременной констатацией ДН? Действительно предвестником развития клинически развернутой стадии ДН является повышение ЭАМ в пределах 30–300 мг/сут. У здоровых лиц экскреция альбумина с мочой составляет в среднем 6,5 мкг/сут [7]. Следует отметить, что диагностирование «высокой нормальной» ЭАМ у больных СД является предиктором развития микроальбуминурии [8, 9]. Ежедневный диапазон в показателях экскреции альбумина как у здоровых людей, так у больных СД составляет 40–45% [10]. По данным длительных наблюдений, наличие микроальбуминурии значительно увеличивает риск сердечно-сосудистых катастроф и смерти от сердечно-сосудистой патологии среди больных СД2 [11, 12]. При СД1 микроальбуминурия также ассоциирована с нефрокардиальной смертностью [13]. По данным исследования FinnDiane (Finnish Diabetic Nephropathy study), наличие микроальбуминурии связано с увеличением общей смертности пациентов СД1 в 2,8 раза [14]. Четкая корреляция микроальбуминурии в развитии неблагоприятного прогноза объясняется ее тесной связью с другими факторами риска сердечно-сосудистой патологии [15]. Основной фактор, определяющий показатель СКФ, является сывороточный уровень эндогенного креатинина. Основным недостатком расчетных формул СКФ выступает сложность его валидизации на тех лиц, у которых уровень креатинина в крови (в силу объема мышечной массы, степени физической активности) может отличаться от среднепопуляционных показателей. Согласно исследованиям, у больных СД выявляется низкий сывороточный уровень креатинина, что объясняется сниженной абсолютной (или относительной на фоне ожирения) мышечной массой [9, 12]. Гипергликемия приводит к развитию гиперфиль...
Наличие увеличения экскреции альбумина с мочой не всегда свидетельствует о неблагоприятном прогнозе в отношении почечной функции, более того, данное состояние оказывается обратимым и в то же время появляются выборки больных с прогрессирующим снижением скорости клубочковой фильтрации (СКФ) без наличия увеличения экскреции альбумина с мочой. Длительное наблюдение P. Fioretto и соавт. за пациентами с ДН после трансплантации поджелудочной железы показало, что через 10 лет при полном устранении гипергликемии наблюдается регресс структурных изменений ткани почек у больных СД 1 типа (СД1) [4–6]. Стойкая нормализация углеводного обмена, а также назначение своевременной терапии для купирования внутриклубочковой гипертензии могут остановить патологический процесс в почках на ранних стадиях. Таким образом, продолжение поиска ранних критериев поражения почек у больных СД остается весьма актуальной проблемой. Что такое ранняя диагностика ДН? Считается ли увеличение экскреции альбумина (ЭАМ) с мочой более 300 мг/сут своевременной констатацией ДН? Действительно предвестником развития клинически развернутой стадии ДН является повышение ЭАМ в пределах 30–300 мг/сут. У здоровых лиц экскреция альбумина с мочой составляет в среднем 6,5 мкг/сут [7]. Следует отметить, что диагностирование «высокой нормальной» ЭАМ у больных СД является предиктором развития микроальбуминурии [8, 9]. Ежедневный диапазон в показателях экскреции альбумина как у здоровых людей, так у больных СД составляет 40–45% [10]. По данным длительных наблюдений, наличие микроальбуминурии значительно увеличивает риск сердечно-сосудистых катастроф и смерти от сердечно-сосудистой патологии среди больных СД2 [11, 12]. При СД1 микроальбуминурия также ассоциирована с нефрокардиальной смертностью [13]. По данным исследования FinnDiane (Finnish Diabetic Nephropathy study), наличие микроальбуминурии связано с увеличением общей смертности пациентов СД1 в 2,8 раза [14]. Четкая корреляция микроальбуминурии в развитии неблагоприятного прогноза объясняется ее тесной связью с другими факторами риска сердечно-сосудистой патологии [15]. Основной фактор, определяющий показатель СКФ, является сывороточный уровень эндогенного креатинина. Основным недостатком расчетных формул СКФ выступает сложность его валидизации на тех лиц, у которых уровень креатинина в крови (в силу объема мышечной массы, степени физической активности) может отличаться от среднепопуляционных показателей. Согласно исследованиям, у больных СД выявляется низкий сывороточный уровень креатинина, что объясняется сниженной абсолютной (или относительной на фоне ожирения) мышечной массой [9, 12]. Гипергликемия приводит к развитию гиперфиль...












