Акушерство и Гинекология №8 / 2017
Исследование экспрессии генов в эутопическом эндометрии женщин с эндометриоидными кистами яичников
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова
Минздрава России, Москва
Цель исследования. Выявление генов, экспрессия которых в эутопическом пролиферативном эндометрии отличается у пациенток с эндометриоидными кистами яичников (ЭКЯ) по сравнению с эутопическим пролиферативным эндометрием женщин без эндометриоза.
Материал и методы. Исследованы 2 группы пациенток: 10 женщин с ЭКЯ (основная группа) и 10 женщин без эндометриоза (группа сравнения). Всем пациенткам было проведено полное клинико-анамнестическое обследование: сбор анамнеза, общий и гинекологический осмотр, УЗИ органов малого таза, клинико-лабораторное обследование. Сбор образцов ткани эутопического эндометрия производился при помощи пайпель-биопсии непосредственно во время операции до проведения гистероскопического исследования с последующим выскабливанием эндометрия и гистологическим исследованием. Из образцов была выделена общая РНК с последующим получением профиля экспрессии с помощью гибридизации на микрочипах GeneChip Human Exon 1.0 ST Arrays (Affymetrix, США) согласно протоколу производителя.
Результаты исследования. В эутопическом пролиферативном эндометрии женщин с ЭКЯ (основная группа) было выявлено повышение экспрессии 27 генов и понижение экспрессии 17 генов (всего микрочип измеряет уровень экспрессии 14 318 транскриптов) по сравнению с эутопическим пролиферативным эндометрием женщин без эндометриоза (группа сравнения). Большая часть этих генов встречаются в работах по экспрессии эутопического эндометрия, таким образом, наши результаты во многом соответствуют опубликованным данным, что делает данные гены перспективными биомаркерами эндометриоза.
Заключение. Полученные данные о повышенной экспрессии генов FOS, EGR-1, FOSB, DUSP1, ZFP36, JUNB и JUN в эутопическом пролиферативном эндометрии женщин с ЭКЯ согласуются с результатами ранее опубликованных работ, что делает данные гены перспективными биомаркерами для создания диагностических систем на основе ПЦР в реальном времени для детекции уровня мРНК в тканях эндометрия.
Эндометриоз – это процесс, при котором за пределами полости матки происходит доброкачественное разрастание ткани, по морфологическим и функциональным свойствам подобной эутопическому эндометрию и так же, как эутопический эндометрий, отвечающей на циклические изменения гормонов яичников [1]. Эндометриоз диагностируется у 10% женщин репродуктивного возраста и 35–50% женщин с тазовой болью и бесплодием. В структуре гинекологической заболеваемости эндометриоз занимает 3-е место после воспалительных заболеваний и миомы матки, приводя к значительным нарушениям репродуктивной функции, стойкому болевому синдрому (71–87%) и бесплодию (21–47%) [1–3].
Причины и механизм развития эндометриоза до настоящего времени не установлены, основные гипотезы связывают развитие этого заболевания с воздействием различных внешних факторов, а также наличием наследственной предрасположенности, или же сочетанием этих причин [4, 5]. Открытыми остаются вопросы этиологии и патогенеза данного заболевания, особенностей клинической картины в зависимости от локализации процесса и тяжести течения заболевания, отсутствуют данные о сравнительной информативности отдельных методов диагностики и выявления рецидивов, а также эффективности различных методов лечения и реабилитации больных [1].
В настоящее время существует множество методов диагностики эндометриоза, однако они обладают довольно низкой специфичностью и позволяют поставить лишь предварительный диагноз, требующий верификации [6]. Единственным методом точной диагностики эндометриоза на сегодняшний день является инвазивное лапароскопическое исследование с прицельной биопсией подозрительных очагов и их последующим гистологическим исследованием [6, 7]. Такие процедуры являются трудоемкими и дорогостоящими, кроме того, временной интервал между первым появлением симптомов и постановкой окончательного диагноза может достигать 8–11 лет [6, 7]. Как показывают опубликованные данные, в 50% случаев эндометриоз может быстро прогрессировать [7, 8]. Таким образом, ранняя неинвазивная и/или малоинвазивная диагностика могла бы значительно ускорить постановку диагноза, после которой пациентки смогли бы обратиться за своевременной медицинской помощью, что имеет ключевое значение для профилактики прогрессирования и рецидивирования заболевания, а также сохранения репродуктивного здоровья пациентки и повышения качества ее жизни в целом.
В течение последних 10–15 лет для поиска маркеров эндометриоза все чаще применяется оценка транскрипционной активности генов, то есть измерение количества мРНК одного или нескольких генов непосредственно в ткани эктопического или эутопического эндометрия. Опубликован целый ряд исследований, посвященных анализу профилей экспрессии эндометрия с помощью микроматриц (mRNA microarray analysis). Этот метод позволяет оценить уровень синтеза мРНК всех уникальных генов человека [7, 9, 10]. Ключевым параметром для микроматричного анализа является плотность покрытия зондами уникальных генов. В последние годы стали доступны так называемые «микроматрицы высокой плотности», значительно точнее оценивающие не только уровень экспрессии каждого отдельного гена, но и всех транскриптов (сплайсоформ) этого гена. В опубликованных результатах исследований уже были выявлены некоторые различия транскрипционной активности генов в эутопическом эндометрии женщин с эндометриозом по сравнению с эутопическим эндометрием от женщин, не страдавших этим заболеванием. Однако в силу различий при составлении анализируемых групп пациенток, равно как и использованных для анализа транскриптомов методов (микрочипов с различным уровнем плотности зондов, а также секвенирования нового поколения (NGS)), полученные различными исследователями данные весьма противоречивы. Кроме того, поскольку эндометриоз является гетерогенным заболеванием, нельзя исключать различий в транскрипционной активности генов эндометрия при разных формах заболевания. Чтобы исключить влияние данного фактора, логично исследовать каждую форму заболевания отдельно, то есть формировать группы пациенток на основании существующей классификации эндометриоза.
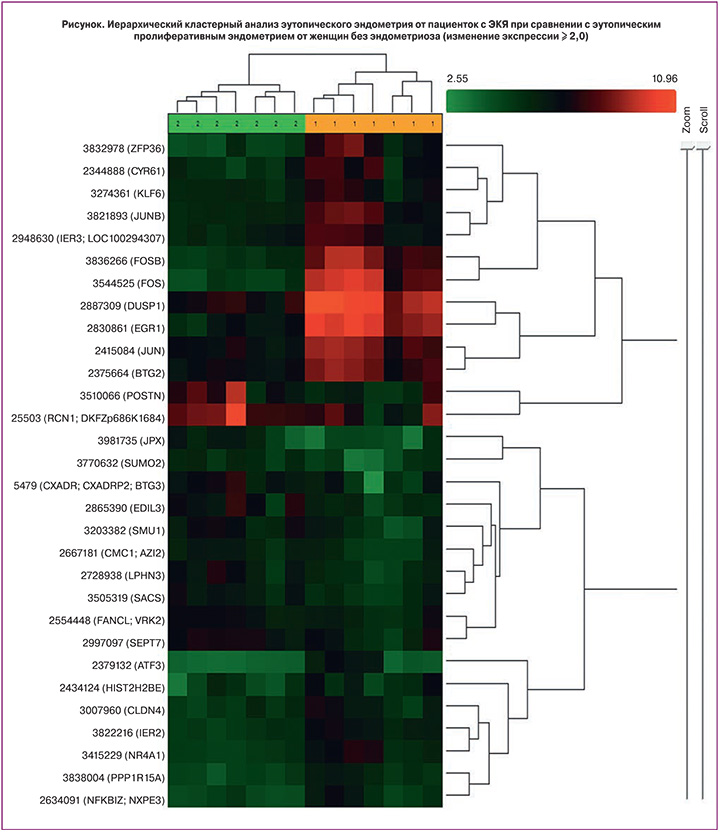
Целью данного исследования было выявление генов, экспрессия которых в эутопическом пролиферативном эндометрии отличается у пациенток с эндометриоидными кистами яичников (ЭКЯ) по сравнению с эутопическим пролиферативным эндометрием женщин без эндометриоза. Для анализа были выбраны микроматрицы с наибольшей плотностью покрытия генома (GeneChip Human Exon 1.0 ST).
Такой анализ позволяет максимально точно сопоставлять экспрессионные профили тканей для выявления генов-кандидатов. Выборка из нескольких генов с повышенной или пониженной при эндометриозе экспрессией в дальнейшем послужит основой для создания ПЦР-систем, позволяющих быстро и недорого оценивать экспрессию генов. Уровень мРНК таких генов может стать основой для набора биомаркеров для диагностики эндометрио...












