Акушерство и Гинекология №3 / 2018
Изменение концентрации внеклеточной ДНК во время беременности
1 ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова Минздрава России, Москва;
2 ГБОУВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России
Последние годы ознаменовались разработкой и внедрением в клиническую практику методов неинвазивного пренатального тестирования анеуплоидий на основе анализа внеклеточной ДНК плода (пДНК) [1]. В настоящее время определение пДНК активно используется в неинвазивной пренатальной диагностике анеуплоидий плода, определении RhD принадлежности и заболеваний, сцепленных с полом плода [2].
Выделяется пДНК из общей внеклеточной ДНК (оДНК), в состав которой входит также ДНК матери (мДНК). Основным источником пДНК в материнской крови являются клетки трофобласта, подвергающиеся апоптозу [3, 4]. Под влиянием гипоксии и окислительного стресса значительно усиливается апоптоз клеток трофобласта, что, как известно, является важным патогенетическим звеном в развитии осложнений беременности, таких как преэклампсия и задержка роста плода [5]. Тем самым, определение концентрации внеклеточной пДНК в крови женщины может также служить маркером патофизиологических изменений в плаценте и предиктором осложнений беременности, ассоциированных с плацентарной дисфункцией. Клиническое применение данного маркера с целью прогнозирования осложнений беременности не может быть реализовано без учета потенциальных факторов, которые могут оказывать влияние на концентрацию внеклеточной пДНК в различные сроки беременности. Так, имеются данные о влиянии возраста женщины, индекса массы тела (ИМТ), курения, массы плода и плаценты. Некоторые исследователи, такие как M. Haghiac и соавт. (2012), продемонстрировали, что концентрация оДНК повышена у женщин с ожирением, в отличие от пДНК [6]. Напротив, O. Lapaire и соавт. (2009) не нашли корреляции концентрации, как оДНК с увеличением ИМТ женщины, так и пДНК [7]. M. Smid и соавт. (2003) обнаружили существенную положительную корреляцию между увеличением массы плаценты и концентрацией пДНК, в то время как другие исследователи аналогичную связь не обнаружили [7, 8]. Кроме того, представляет интерес определение содержания внеклеточной ДНК у женщин с измененным клеточным составом крови вследствие анемии. В литературе имеется только одно исследование, в котором изучали концентрацию пДНК при анемии беременных, однако нет сведений об оДНК и мДНК [9]. Таким образом, существуют противоречивые данные о влиянии материнских и плодовых факторов на уровни внеклеточной мДНК и пДНК в крови матери.
В связи с этим целью данной работы стало определение концентрации внеклеточной ДНК и ее фракций в динамике беременности с учетом возможного влияния ИМТ, анемии беременных, массы плода и плаценты.
Материал и методы исследования
Исследование проводили в ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России с 15 января 2016 г. по 15 апреля 2017 г.
В исследование включены 24 женщины с одноплодной беременностью. Все женщины были соматически здоровы и имели неотягощенный акушерско-гинекологический анамнез. Критериями исключения из исследования послужили такие осложнения беременности, как преэклампсия, преждевременные роды, задержка роста плода, гестационная артериальная гипертензия, гестационный сахарный диабет, хромосомные аномалии и пороки развития плода, аномалии прикрепления и расположения плаценты, острая фаза и обострение хронических инфекционных заболеваний. У 13 женщин беременность протекала без осложнений, у 11 женщин была выявлена анемия легкой степени во II (n=2) и III (n=11) триместрах беременности. На проведение исследования получено разрешение комиссии по этике ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Перед забором биологического материала все женщины подписали информированное согласие на участие в клиническом исследовании.
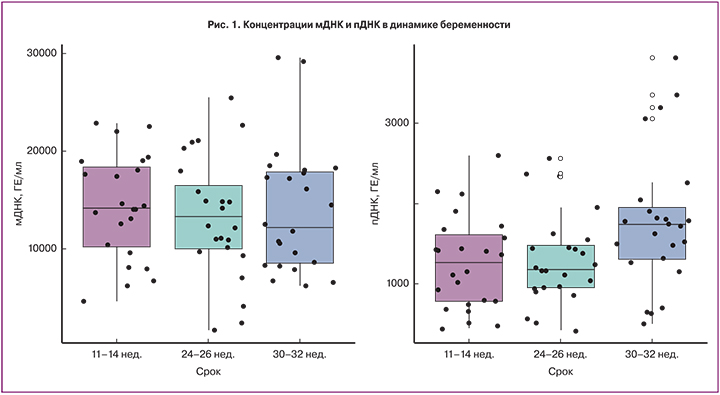
Забор венозной крови для определения внеклеточной ДНК производили трижды: в промежутках 11–14, 24–26 и 30–32 недели. Было собрано по пять мл периферической крови в вакуумные пробирки, содержащие ЭДТА, и обработано в течение часа после забора. Плазма крови была выделена центр фугиров...












