Кардиология №8 / 2014
Карнитин как маркер атеросклероза и других рисков развития сердечно-сосудистых заболеваний
Латвийский институт органического синтеза, лаборатория фармацевтической фармакологии, Рига, Латвия, LV1002, Аизкрауклес ул. 21
L-карнитин впервые выделен из экстрактов мышечных тканей в 1905 г. сотрудниками кафедры медицинской химии Московского университета. Позднее выявлена роль L-карнитина не только в окислении длинноцепочечных жирных кислот, но и в метаболизме углеводов. В наши дни L-карнитин не просто лекарство для лечения патологий связанных с его дефицитом, но и широко распространенная пищевая добавка, которой приписывают способности снижать массу тела и улучшать физические качества человека. Тем не менее в последние годы появившаяся информация о возможной связи L-карнитина с развитием атеросклероза заставляет внимательно оценивать употребление L-карнитина как надежную пищевую добавку без явной необходимости.
L-карнитин (далее — карнитин) впервые выделен в 1905 г. из экстрактов мышечных тканей [1]. Это сделали сотрудники кафедры медицинской химии Московского университета профессор медицинской химии Владимир Сергеевич Гулевич (1867—1933) и физиолог, и биохимик, профессор Робертс Кримбергс (1874—1941). В.С. Гулевич и Р. Кримбергс назвали новое соединение карнитином, ссылаясь на источник его выделения (с латинского «carne» означает «плоть», «мясо»). В 1927 г. определили молекулярную формулу и показали, что карнитин – это γ-амино-β-окси-масляная кислота [2].
В природе биологическую активность и значение имеет только L-карнитин, а другой оптический изомер, D-карнитин, блокирует действие L-карнитина. Так как было установлено, что мышечная ткань содержит много карнитина, различные гипотезы выдвинуты о его роли в нормальной физиологии. В 40—50-е гг. XX века проведено много исследований по изучению роли карнитина в развитии насекомых, а в 1952 г. даже был сделан вывод, что карнитин — это витамин Bt, необходимый для развития червей и личинок [3, 4]. Однако предположение, что карнитин является витамином, оказалось ошибочным, так как в 1961 г. выяснилось, что карнитин появляется в организме в результате биосинтеза [5]. На протяжении многих лет карнитину приписывали всевозможные эффекты, в том числе стимуляцию аппетита и синтеза белка, способствование увеличению массы тела у недоношенных новорожденных и др. [6], однако множество из этих предположений не было подтверждено в клинических исследованиях.
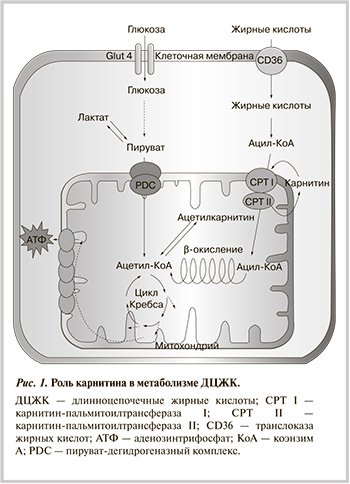 В 50—60-е гг. прошлого века была определена роль карнитина в метаболизме длинноцепочечных полиненасыщенных жирных кислот – ДЦЖК [7, 8], а также роль карнитин-пальмитоилтрансферазы и ацилкарнитиновых эфиров в транспорте ацильных групп ДЦЖК через мембраны митохондрий для осуществления β-окислении жирных кислот (ЖК) [9]. Кроме того, было установлено, что существует активный транспорт карнитина и то, что биопрекурсор карнитина γ-бутиробетаин конкурирует с карнитином [10, 11]. Были также выявлены и врожденные заболевания, связанные с нарушениями метаболизма карнитина или с недостаточной концентрацией карнитина, необходимой для нормальной работы мышечных тканей. Лишь в конце 90-х гг. была произведена молекулярная и функциональная идентификация переносчика карнитина OCTN2 человека [12], а совсем недавно определена структура фермента человека γ-бутиробетаингидроксилазы, синтезирующего карнитин [13].
В 50—60-е гг. прошлого века была определена роль карнитина в метаболизме длинноцепочечных полиненасыщенных жирных кислот – ДЦЖК [7, 8], а также роль карнитин-пальмитоилтрансферазы и ацилкарнитиновых эфиров в транспорте ацильных групп ДЦЖК через мембраны митохондрий для осуществления β-окислении жирных кислот (ЖК) [9]. Кроме того, было установлено, что существует активный транспорт карнитина и то, что биопрекурсор карнитина γ-бутиробетаин конкурирует с карнитином [10, 11]. Были также выявлены и врожденные заболевания, связанные с нарушениями метаболизма карнитина или с недостаточной концентрацией карнитина, необходимой для нормальной работы мышечных тканей. Лишь в конце 90-х гг. была произведена молекулярная и функциональная идентификация переносчика карнитина OCTN2 человека [12], а совсем недавно определена структура фермента человека γ-бутиробетаингидроксилазы, синтезирующего карнитин [13].
До сих пор активно проводятся исследования по оценке фармакологической активности и потенциальном применении карнитина и его производных соединений для лечения различных заболеваний [14], а также возможности регулирования системы карнитина для достижения кардиопротективного действия [15]. Результаты исследований карнитина противоречивы, так как одновременно показано его кардиопротективное действие [16] и участие в развитии атеросклероза [17].
Роль карнитина в энергетическом метаболизме клеток. Для получения энергии клетки мышц используют ЖК и углеводы. После попадания энергетических субстратов в клетку происходят специфические процессы катаболизма, в результате которых образуется общий метаболит — ацетилкоэнзим А (ацетил-КоА). Затем ацетил-КоА вступает в реакции цикла трикарбоновых кислот (Кребса) и последующие процессы дыхательной цепи митохондрий, в результате чего образуется энергия в виде АТФ. Карнитин является одним из факторов, который определяет интенсивность использования ДЦЖК, следовательно, и вклад ЖК в энергетический метаболизм клетки.<...












