Фарматека №7 / 2022
Клиническая иммунология рака молочной железы
Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия
Иммунология – бурно развивающаяся область в клинической онкологии. Комбинированная лекарственная терапия изучается при различных онкологических заболеваниях. За последние годы была разработана иммунотерапия, основанная на ингибировании контрольных точек моноклональными антителами, воздействующими на белок PD-1 и его лиганд PD-L1. Рак молочной железы в отличие от других опухолей относительно поздно стал рассматриваться в иммуноонкологии. В этом обзоре представлены результаты международных и собственных клинических исследований ингибиторов иммунных контрольных точек (ICI) в лечении различных биологических подтипов рака молочной железы. Также рассматриваются прогностическое и предиктивное значение уровня опухоль-инфильтрирующих лимфоцитов (TILs), в частности CD3, CD4, CD8, их корреляции с регуляторными генами (PD-1, PDL-1, FOX-P3).
Введение
Рак молочной железы (РМЖ) включает гетерогенные подтипы, отличающиеся биологией, морфологией и прогнозом. Иммунная система играет двойную роль в развитии и прогрессировании РМЖ, что лучше всего объясняется процессом иммунного редактирования, при котором опухоли подвергаются избирательному иммунному давлению, которое способствует элиминации, иммунному редактированию, в конечном итоге – к «ускользанию» от иммунорегуляторов. Лучшее понимание ранних этапов роста и прогрессирования опухоли должно способствовать разработке эффективных иммунотерапевтических препаратов, которые смещают баланс в сторону уничтожения опухоли. Выбор системной терапии рака молочной железы традиционно основывался на учете уровня экспрессии рецепторов экстрогена (ER), рецепторов прогестерона (PR) и/или HER2neu рецепторов. На основании экспрессии этих биомаркеров РМЖ можно разделить на четыре биологических (суррогатных) подтипа: люминальный (А и В), HER2-положительный, тройной негативный рак молочной железы (ТНРМЖ). Эти подтипы в большинстве случаев особые по иммуноспецифичности, различаясь по количеству опухольинфильтрирующих лимфоцитов (TILs), экспрессии PD-L1, опухоль-ассоциированными антигенами, в т.ч. опухолевой мутационной нагрузкой (TMB – tumor mutational burden) [1, 3].
Примечательно, что исследования, касающиеся иммунотерапии РМЖ, изначально шли медленнее по сравнению с другими солидными опухолями, количество некоторых исследований, посвященных изучению иммунотерапевтических средств, в последнее время серьезно увеличилось. Эти исследования проводятся параллельно на метастатических и ранних стадиях, что весьма перспективно, поскольку активность современных лекарственных средств изучалась на поздних стадиях [1].
1. Иммунный надзор рака молочной железы
1.1. РМЖ является иммуногенным
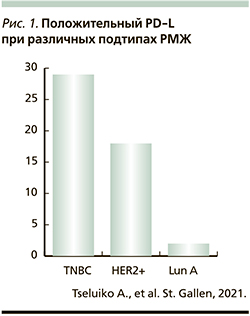
РМЖ исторически считался неиммуногенным. Однако теперь ясно, что некоторые опухоли молочной железы естественным образом индуцируют адаптивный иммунный ответ, содержат опухоль-инфильтрирующие Т-клетки (TIL) и могут также экспрессировать лиганд PD-1 белка PD-L1. Понятно, что как содержание TILs, так и экспрессия PD-L1 различаются в основных клинических подтипах (рис. 1) РМЖ. Последний с преобладанием лимфоцитов [Lymphocyte predominant breast cancers] (LPBCs) – это опухоли молочной железы, в которых стромальные или внутриопухолевые лимфоциты составляют от 50 до 60% опухолевой ткани, хотя существует линейная, а не дихотомическая связь между уровнем TILs и клиническими результатами. Присутствие TILs при постановке диагноза обеспечивает как прогностическую, так и предиктивную значимость независимо от подтипа РМЖ [4–6].
1.1. Прогностическое значение опухольинфильтрирующих лимфоцитов (TILs)
Ретроспективно-проспективный анализ данных почти 16 тыс. пациентов в пяти клинических испытаниях показал, что наличие стромальных TILs при постановке диагноза прогностическое для ТНРМЖ и HER2+ РМЖ, но не для люминального ER+/ PR+ РМЖ. У 821 пациента с ТНРМЖ в трех исследованиях наблюдалось улучшение безрецидивной выживаемости на 15–20% на каждые 10% увеличения числа стромальных TILs, определемых при окрашивании гематоксилином и эозином (H&E) (p=0,005–0,035). У 387 пациентов с HER2-позитивным РМЖ частота рецидивов снижалась на 3% на каждый 1% увеличения стромальных TIL при окрашивании H&E (p=0,002) [4]. В исследовании Ali et al. [36] оценены данные 12 366 пациентов со стромальным или внутриопухолевым CD8+TILs и продемонстрировано отсутствие значимого влияния внутриопухолевых CD8+-TIL на безрецидивную выживаемость (DFS) при ER+позивтивном РМЖ, но выявлено положительное влияние стромальноых CD8+-TILs на выживаемость при ER-/ HER2+-РМЖ железы.
1.1. TIL как предиктивный (предсказательный) фактор ответа на терапию TILs также может быть предиктивным биомаркером ответа на терапию. Высокие уровни TILs при постановке диагноза, т.е. до неоадъювантного и адъювантного лечения, связаны с большей пользой при проведении адъювантной терапии антрациклинами, что согласуется с данными, согласно которым химиотерапия на основе антрациклинов индуцирует иммуногенную гибель клеток через путь Toll-like receptor 4 (TLR-4). Данные по адъювантной терапии с применением трастузумаба противоречивы. В исследовании FinHER высокая плотность (density) TILs была связана с ответом на трастузумаб, тогда как в исследовании NCCTG N9831 таковой зависимости выявлено не было. Более того, стромальные TILs (по H&E) могут предсказывать частичный клинический ответ (cPR) на неоадъювантную химиотерапию. Величина частичного клинического ответа (cPR) при всех подтипах РМЖ приблизительно на 30% выше, когда опухоли молочной железы содержат более 60% TILs, чем когда они содержат менее или равные 60% TILs [4]. Добавление карбоплатина к стандартной неоадъювантной терапии увеличивало частоту cPR при HER2+-РМЖ и ТНРМЖ с 50 до 78% и с 43 до 74% соответственно (p<0,005). Остаточное заболевание (RD – Residual disease) после неоадъювантной химиотерапии служит отягчающим прогностическим фактором для HER2+-РМЖ и ТН...












