Клиническая Нефрология №4 / 2014
Клиническая оценка циркулирующего (pro-ANP) и локально-почечного (CGMP) натрийуретических пептидов при протеинурических формах хронических гломерулонефритов
МПФ ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва
Цель. Определить соотношение сывороточного уровня предшественника предсердного натрийуретического пептида (pro-ANP) и мочевой экскреции цГМФ (cGMP) и на основании полученных данных охарактеризовать их взаимосвязь со степенью активности хронического гломерулонефрита (ХГН).
Материал и методы. Обследованы 47 больных ХГН: 19 женщин и 28 мужчин в возрасте от 17 до 62 лет. Группы больных разделялись в зависимости от клинического варианта и степени активности ХГН. Группу I составили 10 пациентов с нефротическим синдромом (НС) и почечной недостаточностью (ПН). Группа II – 14 пациентов с НC без ПН. Группа III – 10 больных с умеренным мочевым синдромом (МС). Группа IV – 11 больных гематурической формой ХГН. Контрольную группу составили 9 здоровых лиц, сопоставимых по полу и возрасту с обследованными больными.Во всех группах определены уровень pro-ANP в плазме крови и экскреция cGMP с мочой методом конкурентного иммуноферментного анализа.
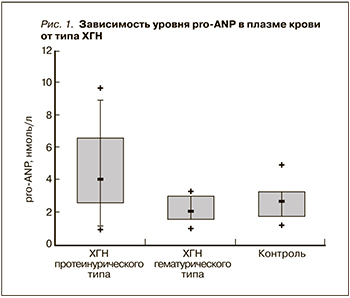
Результаты. У больных ХГН уровень экскреции cGMP с мочой был ниже, чем у здоровых лиц, и зависел от степени активности почечного поражения. Концентрация cGMP в моче всех больных ХГН с активным нефротическим синдромом (НС) была достоверно ниже, чем у пациентов с ремиссией ХГН, а наиболее низкая мочевая экскреция сGMP отмечена у больных НС и ПН. Уровень pro-ANP в плазме крови имел прямую корреляционную связь со степенью активности нефрита. Так, у пациентов I и II групп данный показатель был достоверно выше, чем в контрольной группе, а самые высокие значения были в группе больных ПН.
Заключение. Определение уровней pro-ANP и сGMP может использоваться для определения активности и предсказания течения хронического гломерулонефрита с НС.
Введение
Среди клинических вариантов хронических гломерулонефритов (ХГН) протеинурические формы считаются одними из самых тяжелых по своим клиническим проявлениям и особенно прогнозу в связи с установленной самостоятельной нефротоксичностью протеинурии (ПУ), а также высоким риском серьезных осложнений нефротического синдрома (НС), включая нефротический криз, который потенциально может стать причиной неблагоприятного исхода. Традиционно степень ПУ и НС у больных ХГН рассматривают как клинический эквивалент активности нефрита, однако механизмы, лежащие в основе развития высокой ПУ и НС, остаются недостаточно расшифрованными. В настоящее время большое внимание уделяется исследованию вклада натрийуретических пептидов в формирование НС при ХГН.
Ранее натрийуретические пептиды рассматривали только в качестве показателей выраженности сердечной недостаточности.
Однако в последнее время была установлена возможность изменения уровня предсердного натрийуретического фактора (ANP) в зависимости от выраженности клинических проявлений ХГН [1]. В клинических условиях натрийуретические пептиды, в частности предшественник ANP (pro-ANP), исследовались мало, а их роль в оценке активности ХГН практически не изучена.
 Известно несколько механизмов регуляции водно-солевого обмена. В частности, было показано, что увеличение объема внеклеточной жидкости при НС служит триггером, стимулирующим активность ANP, что в свою очередь ведет к усилению натрийуреза. Существует гипотеза, согласно которой высокий уровень ANP при НС свидетельствует о наличии сниженной чувствительности рецепторов в дистальных канальцах к действию этого пептида. Этот феномен может быть также объяснен ускоренной деградацией его вторичного мессенджера – циклического гуанозин-монофосфата (cGMP) [2]. Кроме того, просматривается связь между задержкой натрия при НС и экспрессией натрийуретических пептидных рецепторов типа А (NPRA). В самом раннем периоде развития НС на животных моделях было продемонстрировано снижение экскреции натрия и его задержка, несмотря на повышение синтеза ANP, возможно вследствие сниженной экспрессии NPRA рецепторов а также повышенной активности фосфодиэстеразы типа 5, ответственной за катаболизм cGMP [3].
Известно несколько механизмов регуляции водно-солевого обмена. В частности, было показано, что увеличение объема внеклеточной жидкости при НС служит триггером, стимулирующим активность ANP, что в свою очередь ведет к усилению натрийуреза. Существует гипотеза, согласно которой высокий уровень ANP при НС свидетельствует о наличии сниженной чувствительности рецепторов в дистальных канальцах к действию этого пептида. Этот феномен может быть также объяснен ускоренной деградацией его вторичного мессенджера – циклического гуанозин-монофосфата (cGMP) [2]. Кроме того, просматривается связь между задержкой натрия при НС и экспрессией натрийуретических пептидных рецепторов типа А (NPRA). В самом раннем периоде развития НС на животных моделях было продемонстрировано снижение экскреции натрия и его задержка, несмотря на повышение синтеза ANP, возможно вследствие сниженной экспрессии NPRA рецепторов а также повышенной активности фосфодиэстеразы типа 5, ответственной за катаболизм cGMP [3].
Более того, установлена связь натрийуретического эффекта ANP с активацией почечных допаминовых рецепторов (D1R). Допамин как в проксимальных канальцах, так и в дистальных сегментах нефрона снижает реабсорбцию натрия при помощи ингибирования натрий/калиевой АТФазы и протонно-натриевого обмена. В основе взаимодействия этих двух натрийуретических систем при НС лежит способность ANP перемещать «спящие» допаминовые рецепторы из клеток почечных канальцев в плазменную мембрану, где они становятся функционально активными.
Показано, что натрийуретические пептиды являются антагонистами ренин-ангионтензин-альдостероновой системы (РААС). На основании гистологического исследования почечной ткани мышей был сделан вывод о ренопротективных свойствах систем эндогенной натрийуретической пептидной/гуанилат циклазы А (ГЦА) через ингибирование РААС и оксидативного стресса в подоцитах [4].
С учетом многофункциональности натрийуретических пептидов в условиях персистирующей задержки натрия и НС можно предполагать наличие связи между изменениями уровня этих пептидов и клинической активностью нефротических форм ХГН.
Целью настоящего исследования было охарактеризовать взаимосвязи плазменного уровня pro-ANP и экскреции вторичного мессенджера этого пептида (cGMP) со степенью активности ХГН.
Материал и методы
Обследованы 47 больных ХГН: 19 женщин (40 %) и 28 мужчин (60 %) в возрасте от 17 до 62 лет (в среднем 38,10 ± 13,96 года), наблюдавшихся в клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева ГБОУ ВПО «Первый МГМУ им И.М. Сеченова» Минздрава России с 2011 по 2013 г.
Контрольную группу составили 9 здоровых лиц, сопоставимых по полу и возрасту с обследованными больными ХГН: 6 женщин и 3 мужчины от 22 до 62 лет (средний возраст – 46,0 ± 14,5 лет). Результаты исследования сравнивали в четырех группах больных.
В группу I вошли 10 пациентов с НС, ПУ (9,00 ± 3,13 г/сут, альбумин сыворотки – 24 ± 3,5 г/л), минимальной эритроцитурией (от 10–15 до 20 в п/зр) и с нарушением функции почек ...












