Кардиология №4 / 2014
Клинический опыт применения милдроната при восстановительном лечении пациентов с дисплазией соединительной ткани
ГБОУ ВПО Омская государственная медицинская академия Минздрава России, 644043 Омск, ул. Ленина, 12
Дисплазия соединительной ткани — ДСТ (dis — нарушение; plasio — развитие) — нарушение развития соединительной ткани в эмбриональном и постнатальном периодах вследствие генетически измененного фибриллогенеза внеклеточного матрикса с нарушением процессов катаболизма и анаболизма соединительной ткани, приводящее к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений локомоторных и висцеральных органов с прогредиентным течением [1].
 В любой системе организма развитие патологического процесса изменяет афферентное влияние на кардиовазомоторные центры, особенно, если имеются отклонения параметров внутренней среды организма (газового состава, электролитного равновесия и пр.), как, например, у пациентов с ДСТ [2]. Изменения регуляции сердца носят приспособительный характер, обеспечивая его гиперфункцию и кровообращения в целом, и направлены на устранение возникающих отклонений. На этом фоне происходят нарушения обмена веществ соответственно возросшей функции миокарда. Продолжительная гиперфункция миокарда в неблагоприятных условиях генетических дефектов чревата возникновением дефицита энергетических возможностей. Кроме того, наличие нарушений обмена кислорода при бронхолегочном синдроме и гипервентиляции при синдроме вегетососудистой дистонии, который в 80% наблюдается у пациентов с ДСТ, также вносит вклад в усугубление дефицита энергии [3]. Напряженное функционирование симпатического звена при ДСТ приводит к нарушению экономичности работы сердца, функционирующего в этих условиях с максимальной затратой энергии. Это ведет к нецелесообразному расходу ресурсов и истощению миокарда. Наличие клапанного синдрома у лиц с ДСТ способствует локальной или распространенной кардиомиопатии, которая также приводит к усугублению нарушений обмена веществ. Подобные изменения связаны с выраженной тракцией папиллярных мышц при пролабировании клапанного аппарата или натяжением аномальных хорд, препятствующих кровоснабжению миокарда. Присоединение регургитации при клапанном синдроме увеличивает нагрузку на миокард, сопровождающуюся усугублением энергетических расстройств.
В любой системе организма развитие патологического процесса изменяет афферентное влияние на кардиовазомоторные центры, особенно, если имеются отклонения параметров внутренней среды организма (газового состава, электролитного равновесия и пр.), как, например, у пациентов с ДСТ [2]. Изменения регуляции сердца носят приспособительный характер, обеспечивая его гиперфункцию и кровообращения в целом, и направлены на устранение возникающих отклонений. На этом фоне происходят нарушения обмена веществ соответственно возросшей функции миокарда. Продолжительная гиперфункция миокарда в неблагоприятных условиях генетических дефектов чревата возникновением дефицита энергетических возможностей. Кроме того, наличие нарушений обмена кислорода при бронхолегочном синдроме и гипервентиляции при синдроме вегетососудистой дистонии, который в 80% наблюдается у пациентов с ДСТ, также вносит вклад в усугубление дефицита энергии [3]. Напряженное функционирование симпатического звена при ДСТ приводит к нарушению экономичности работы сердца, функционирующего в этих условиях с максимальной затратой энергии. Это ведет к нецелесообразному расходу ресурсов и истощению миокарда. Наличие клапанного синдрома у лиц с ДСТ способствует локальной или распространенной кардиомиопатии, которая также приводит к усугублению нарушений обмена веществ. Подобные изменения связаны с выраженной тракцией папиллярных мышц при пролабировании клапанного аппарата или натяжением аномальных хорд, препятствующих кровоснабжению миокарда. Присоединение регургитации при клапанном синдроме увеличивает нагрузку на миокард, сопровождающуюся усугублением энергетических расстройств.
Следовательно, при ДСТ происходят динамические изменения обмена, функции и структуры миокарда как врожденного, так и приобретенного характера. Патогномоничных субъективных признаков возникающих изменений обмена веществ в миокарде не существует. Явления метаболической недостаточности миокарда у пациентов с ДСТ сопровождаются болями в сердце, астенизацией личности (раздражительностью, нарушением сна, плаксивостью), понижением артериального давления или реже повышением, снижением работоспособности и как следствие низким уровнем качества жизни (КЖ). Формирующаяся метаболическая кардиомиопатия при ДСТ, не имея специфических субъективных симптомов и клинических проявлений, определяет потенциально повышенный риск формирования аритмического синдрома и внезапной смерти в молодом возрасте у пациентов данной категории.
В связи с этим представляется патогенетически обоснованным применение препаратов, таких как цитопротектор милдронат, способного сохранять функциональную активность миокарда, повышать его жизнеспособность и в значительной степени ускорять восстановление функции миокарда [4].
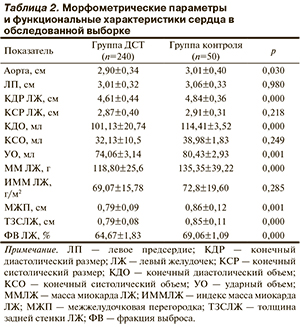 В многочисленных исследованиях милдронат продемонстрировал свой терапевтический потенциал в усл...
В многочисленных исследованиях милдронат продемонстрировал свой терапевтический потенциал в усл...












