Акушерство и Гинекология №5 / 2017
Комбинация протеомного и транскриптомного подходов для определения риска малигнизации неоплазий шейки матки при папилломавирусной инфекции
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова
Минздрава России, Москва
Цель исследования. Изучить протеомный состав цервиковагинальной жидкости (ЦВЖ) у пациенток репродуктивного возраста для определения риска малигнизации неоплазий шейки матки при папилломавирусной инфекции
Материал и методы. Клинические, молекулярно-генетические методы исследования, цитологическое исследование, расширенная кольпоскопия, полимеразная цепная реакция, протеомное исследование цервиковагинальной жидкости.
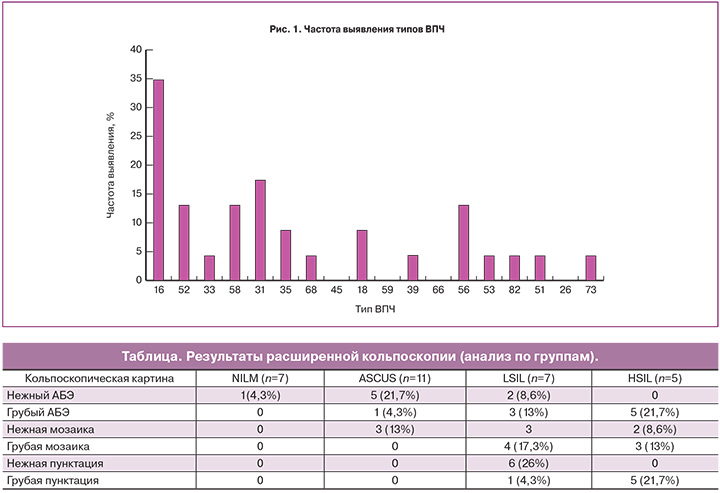
Результаты. Обследовано 30 женщин, сформировано 4 группы: 7 пациенток (23%) – NILM (I группа – контрольная), 23 (77%) – вирус папилломы человека (ВПЧ)-позитивные, разделены на 3 группы: II группа – 11 (49%) с ASCUS, III группа – 7 (30%) с LSIL, IV группа – 5 (21%) с HSIL. ВПЧ высокого онкогенного риска выявлен в 90,9% случаев в группе ASCUS и в 100% – в группах LSIL и HSIL. Наиболее распространенным типами были ВПЧ 16 (34,8%), 31 (17,4%), 52, 58, 56 (13%), 18, 35 (8,7%), остальные типы встречались менее чем в 5% случаев. У 69% пациенток вирусная нагрузка была более 5,2lоg (в среднем – 5,6log) без существенных различий между группами. Нормальная кольпоскопическая картина наблюдалась у 7 (23%) пациенток, ненормальная – у 23 (87%). По полуколичественному анализу протеомного состава ЦВЖ было выявлено достоверное разделение контрольных образцов (NILM) и групп ASCUS, LSIL, HSIL. Концентрация белков теплового шока S100-A9, S100-P, S100-A11, HSPA8, а также ацетил-CoA-связывающего белка и аннексинов A1 и A2 в группах с неоплазией на порядок выше, чем в контрольной группе. Многофакторный анализ протеомных и транскриптомных данных пациентов был выполнен методом PLS. В результате достигнуто достоверное разделение группы с низким риском развития и прогрессии цервикальной дисплазии и группы высокого риска.
Заключение. Выявлены белки ЦВЖ, внесшие важный вклад в дифференциацию групп с нормальным эпителием шейки матки от групп с неоплазией различной степени тяжести.
Вирус папилломы человека (ВПЧ) вызывает заболевания шейки матки, которые способны трансформироваться в рак шейки матки (РШМ) [1]. Ежегодно в мире регистрируются более 400 000 новых случаев РШМ, половина из которых заканчивается летальным исходом (высокий процент этих случаев приходится на женщин репродуктивного возраста) [2].
РШМ предшествуют цервикальные интраэпителиальные неоплазии (CIN). Выбор правильного объема лечения является ключевым моментом в ведении пациенток с CIN, так как слишком радикальная терапия может поставить под угрозу репродуктивную функцию пациенток, а слишком щадящая может оказаться недостаточно эффективной и заболевание может прогрессировать дальше.
Для многих акушеров-гинекологов вопрос ведения пациенток с CIN I является крайне спорным: лечить или динамически наблюдать? Деструктивная терапия может быть оправдана для пациенток, которые относятся к группе высокого риска по прогрессированию заболевания. В отношении пациентов с низким риском, к чему относится спонтанная регрессия, можно выбрать тактику динамического наблюдения. В связи с этим возникает необходимость в поиске и определении эффективных специфичных биомаркеров, обнаруживаемых при помощи молекулярно-генетических методов исследования и оценки молекулярного состава биологических жидкостей и тканей при помощи масс-спектрометрии и ядерно-магнитного резонанса [3].
Исследования последних 10 лет подтвердили высокий потенциал диагностики и прогнозирования различных заболеваний при помощи биологических жидкостей организма, в том числе цервиковагинальной жидкости (ЦВЖ) [4]. Изменение молекулярного состава ЦВЖ может дать важную информацию о патогенезе многочисленных гинекологических заболеваний, в первую очередь – хронических воспалительных процессов нижнего отдела генитального тракта. Изучение протеомного состава ЦВЖ раскрыло патогенетический аспект целого ряда гинекологических заболеваний, таких как бактериальный вагиноз, вагиниты, цервициты [5].
Анализ ЦВЖ с использованием методов протеомики может дать новую информацию о нарушениях реакций иммунитета женских половых органов при ВПЧ-инфекции и ассоциированных с ним заболеваний шейки матки и более глубоко изучить этиологию и патогенез указанных заболеваний.
Цель исследования: изучить протеомный состав ЦВЖ у пациенток репродуктивного возраста для определения риска малигнизации неоплазий шейки матки при ВПЧ-инфекции.
Материал и методы исследования
В одномоментное проспективное исследование были включены 30 женщин в возрасте от 21 до 45 лет (средний возраст 30,5 года), обратившиеся в научно-поликлиническое отделение ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России по поводу наличия патологии шейки матки. Критерии включения: ВПЧ-инфекция, ВПЧ-ассоциированные заболевания шейки матки, регулярный менструальный цикл. Критерии исключения: беременность, период лактации, прием гормональной терапии, наличие инфекций, передающихся половым путем, нарушение функции почек, печени, легких в стадии декомпенсации, наличие психоневрологических заболеваний. Среднее время наблюдения за пациентками составило 6 месяцев.
Комплексное обследование женщин включало: сбор жалоб, анамнеза, гинекологический статус, молекулярно-биологические методы исследования, цитологическое исследование, расширенную кольпоскопию, протеомное исследование ЦВЖ.
Для оценки кольпоскопической картины применяли единую Международную кольпоскопическую классификацию, одобренную на 14-м Всемирном конгрессе IFCPC в Рио-де-Жанейро (2011 г.). Использовалась цитологическая оценка мазков с шейки матки по системе Бетесда (2004) [6].
Для протеомного анализа проводился забор ЦВЖ после орошения влагалища и шейки матки 5 мг раствором натрия хлорида 0,9%. Забранная жидкость центрифугировалась при условиях: скорость, время и температура центрифугирования 2000 g 10 мин при 4°C.
Для определения мРНК функциональных генов человека забирался мазок из переходного эпителия цервикального канала щеткой, помещался в раствор гуанидина тиоцианата, не центрифугировался.
Для ВПЧ-генотипирования 21-го типа забирался мазок из зоны переходного эпителия щеткой, помещался в пробирку объемом 1,5 мл с 0,9% раствором натрия хлорида (500 мкл), затем центрифугировалось при условиях: 13000 об./мин 10 мин при комнатной температуре.
К образцам ЦВЖ добавляли во...












