Фарматека №8 (321) / 2016
Комбинация вемурафениб кобиметиниб принципиально меняет прогноз метастатической меланомы
ФГБУ НИИ онкологии им. Н.Н. Петрова Минздрава России, Санкт-Петербург
В обзоре приведен анализ результатов ключевых исследований, в которых оценивалась эффективность и безопасность препаратов кобиметиниб (Котеллик) и вемурафениб (Зелбораф) как в составе комбинированной терапии, так и в качестве монопрепаратов для пациентов с меланомой кожи. В ключевом исследовании coBRIM ранее не получавшие лечение пациенты с меланомой кожи IIIC или IV стадий заболевания и наличием мутации в гене BRAF V600, получали комбинированную терапию кобиметиниб+вемурафениб или вемурафениб в монорежиме. Показано достоверное преимущество комбинации кобиметиниба с вемурафенибом: увеличение времени без прогрессирования, общей выживаемости, частоты объективных ответов. Профиль токсичности комбинации кобиметиниба и вемурафениба был приемлемым и управляемым. Таким образом, комбинированная терапия кобиметинибом в сочетании с вемурафенибом обладает высоким терапевтическим потенциалом и является новым стандартом лечения пациентов с метастатической меланомой с наличием мутации в гене BRAF V600.
Эпидемиология меланомы кожи в Российской Федерации
На протяжении последних десятилетий в мире отмечается неуклонный рост заболеваемости меланомой кожи (МК), превысившей 200 тыс. вновь выявленных больных в год. Наряду с ростом заболеваемости отмечается и рост показателей смертности [1]. На территории Российской Федерации ежегодно регистрируется в среднем 8000 новых случаев МК, при этом средний показатель заболеваемости в 2013 г. составил 6,25 на 100 тыс. населения (5,1 для мужчин и 7,25 для женщин), среднегодовой темп прироста – 2,59%, а прирост за 10-летний период – 30,23%. Стандартизированный показатель заболеваемости в 2013 г. находился в пределах 3,77 у мужчин и 4,28 у женщин на 100 тыс. населения [2–3].
На фоне роста заболеваемости МК отмечается увеличение показателей смертности. Стандартизированный показатель смертности от меланомы в Российской Федерации в 2013 г. составил 1,48 на 100 тыс. населения. За 10-летний период (2003–2013) у мужчин на фоне значительного снижения стандартизованного показателя смертности (-11,3%) от всех злокачественных новообразований отмечено нарастание показателя смертности от МК (14,7%). Среди женского населения наблюдается та же тенденция: снижение общего стандартизованного показателя смертности (-6,9%) и рост показателя смертности от МК (8,0%).
Средний возраст больных меланомой с впервые в жизни установленным диагнозом составил 60,8 года. Наибольшая заболеваемость отмечена в возрасте 75–84 лет. Следует отметить рост заболеваемости и среди лиц молодого возраста. Среди всех онкологических заболеваний у пациентов в возрасте 20–25 лет удельный вес МК занимает 4-е место [3]. Особую социальную значимость МК придает высокая смертность: на долю заболевания приходится всего 4% злокачественных новообразований кожи, но до 80% смертельных исходов. Такой уровень смертности обусловлен высоким метастатическим потенциалом опухоли и низкой эффективностью системной терапии диссеминированных форм заболевания. Если при ранней стадии заболевания 5-летняя выживаемость превышает 90%, то при II составляет около 65%, при III (локально-регионарной) снижается до 45%, а при IV (метастатической) стадии не превышает 10%. К сожалению, в России около 25% пациентов на момент установления диагноза имеют запущенные (III–IV) стадии заболевания [4].
Таргетная терапия метастатической меланомы
При неуклонном росте заболеваемости и отсутствии эффективных методов терапии большие надежды возлагаются на реализацию достижений молекулярно-генетических исследований. За последние годы удалось расшифровать сложный генетический профиль меланомы и показать, насколько гетерогенна опухоль. Открыты новые пути сигнальной трансдукции, определены и изучаются молекулярные мишени таргетной терапии [5, 6].
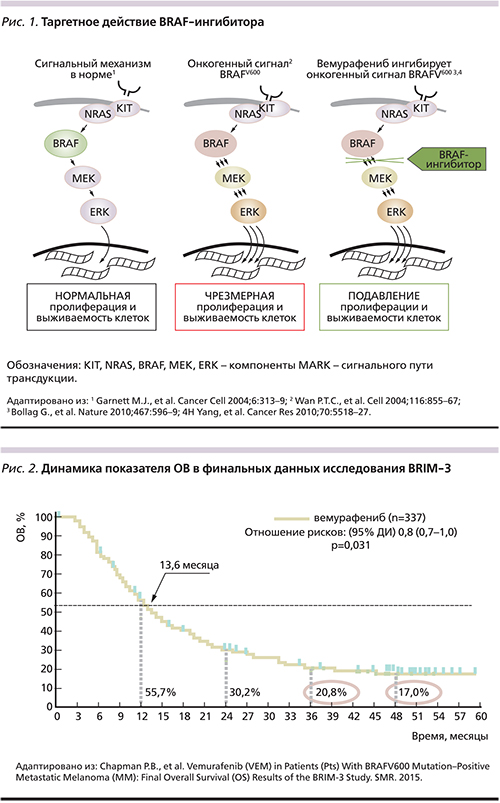
Появление молекулярно-направленных таргетных препаратов, а также ингибиторов иммунных «точек контроля» изменило тактику лечения больных метастатической меланомой (мМК) [7, 8]. МАРК (mitogen_activated protein kinase) – сигнальный путь трансдукции, включающий RAS (HRAS, NRAS, KRAS), RAF серин/треониновые протеинкиназы (ARAF, BRAF, CRAF), MEK, ERK; регулирует клеточный рост, дифференцировку, апоптоз и играет ключевую роль в прогрессировании меланомы (рис. 1) [7, 9–15]. Активирующие BRAF-мутации (чаще всего BRAF V600E) определяются примерно у 50% больных МК и приводят к активации MAPK сигнального каскада [16]. У больных неоперабельной или метастатической меланомой с наличием мутации в гене BRAF V600, BRAF-ингибиторы вемурафениб и дабрафениб продемонстрировали высокую эффективность [8].
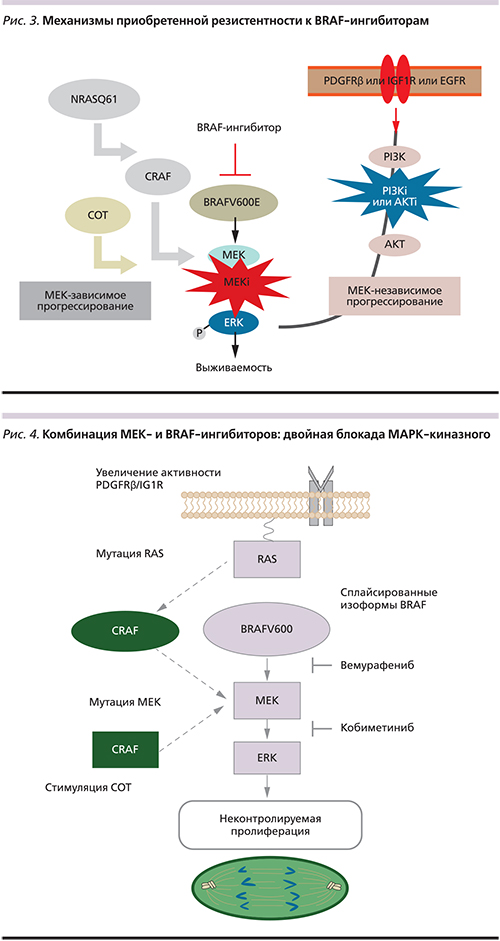
Рандомизированное исследование BRIM-3, на основании которого вемурафениб был одобрен Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA), продемонстрировало явные преимущества препарата перед стандартной химиотерапией: было отмечено увеличение общей выживаемости (ОВ) (13,6 против 9,7 месяца, p<0,001), выживаемости без прогрессирования (ВБП) (6,9 против 1,6 месяца, p<0,001). Частота объективных ответов на терапию вемурафенибом была в 9 раз выше, чем у дакарбазина (57 и 9% соответственно) [17]. Согласно финальным данным исследования BRIM-3, 17% пациентов мМК живы в течение 4 лет и более на фоне терапии вемурафенибом (рис. 2) [18].
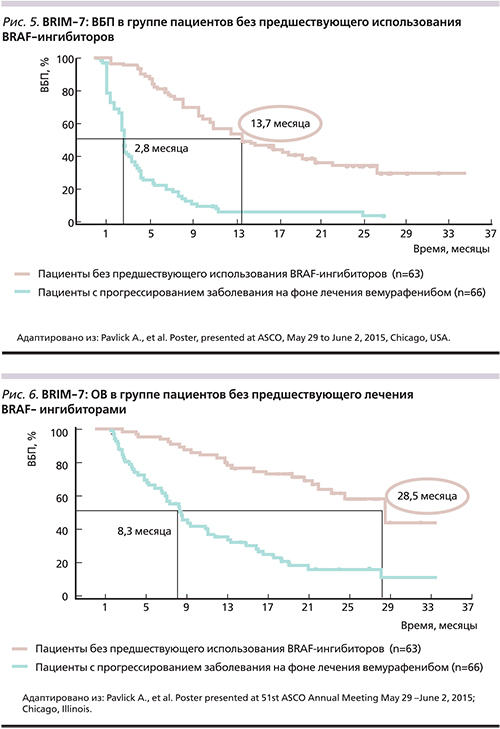
Механизмы резистентности к BRAF-ингибиторам
Примерно у 15% пациентов отмечается первичная резистентность к BRAF-ингибиторам [16]. Определены возможные множественные механизмы первичной резистентности к BRAF-ингибиторам, включившие наличие RACI P29S-мутации, потерю функции PTEN, дисрегуляцию циклин-зависимой киназы-4 и циклин D1, инактивацию NF1, активацию киназы COT1, секрецию стромального фактора роста гепатоцитов и мутации в HOXD8 [16]. Интересно, что подобная геномная гетерогенность опухоли не оказывает отрицательного воздействия на результат лечения в случае комбинированной терапии BRAF- и МЕК-ингиби...












