Трудный диагноз в педиатрии №4 / 2016
Лабораторная диагностика: необходимая и достаточная
Данная рубрика возникла в связи с необходимостью расширения знаний врачей по отдельным нозологиям и методам обследования в крупном многопрофильном стационаре, которым является Морозовская детская городская клиническая больница. Ежедневно в лаборатории больницы выполняются тысячи анализов по различным необходимым направлениям. Лаборатория оснащена по последнему слову техники, имеет приборы, позволяющие врачам на основе современных методов диагностики (как отечественных, так и зарубежных) оценивать ситуацию в кратчайшие сроки от момента поступления больного в стационар. Однако, как показал разбор историй болезни по разным отделениям больницы, не все анализы, выполненные в лаборатории и требующие не только их интерпретации, но и дальнейших действий (алгоритма лечения, сроков амбулаторного наблюдения в динамике, определения периодов взятия повторных анализов, последующего амбулаторного осмотра специалистами и госпитализации), бывают оценены, объяснены и внесены в историю болезни. Огромное количество анализов выполняются как «рутинные», на которые затрачиваются не только средства, но и рабочее время врачей-лаборантов, а цель их определения остается неясной. К сожалению, многие анализы остаются невостребованными, а это в свою очередь может отражаться на результатах лечения.
Имеются определенные трудности в интерпретации остроты и необходимости лечения различных инфекций. Ряд выявленных возбудителей вообще не упоминается при выписке в диагнозах, отсутствуют рекомендации по лечению. Очевидно, это обстоятельство требует более сплоченной совместной работы высококвалифицированных врачей различных подразделений и лабораторной службы, взаимопонимания, более внимательного и бережного отношения к назначаемым анализам и получаемым ответам.
Надеемся, что данная рубрика принесет пользу и внесет определенную ясность в работу не только лабораторной службы, но и всех подразделений стационара.
CLOSTRIDIUM DIFFICILE У ДЕТЕЙ: КОМУ ПОКАЗАНО ОБСЛЕДОВАНИЕ?
Clostridium difficile — возбудитель относится к спорообразующим анаэробным грамположительным бациллам, которые могут длительно существовать в виде спор в окружающей среде (в частности, в почве). Основной путь передачи — фекально-оральный и контактный. Заражение также может происходить через руки медицинского персонала и медицинское оборудование. Прежде всего C.difficile является причиной внутрибольничной инфекции, но может быть и внебольничной. Источником инфекции является человек. Характерно воспаление толстой кишки. Свое название бактерия получила в связи с трудностями ее выделения и культивирования и называлась раньше — Bacillus difficilis [1].
В целом к роду Clostridia относятся заболевания с энтеральным путем передачи (ботулизм, клостридиальный гастроэнтерит, клостридиальный некротический энтерит) и травматическим (столбняк, анаэробная инфекция). История свидетельствует о том, что одно из первых упоминаний о столбняке было сделано еще Гиппократом. В Средние века был описан ботулизм. И гораздо позже, в ХХ веке, появилась информация о клостридиальном некротическом гастроэнтерите. В 1935 году впервые Ivan C. Hall и Elizabeth O'Toole описали и назвали возбудителя Bacillus difficilis [1,2], выделив его от здорового новорожденного. Поэтому поначалу данный возбудитель был причислен к непатогенным. И лишь значительно позже, в 1978 году, бацилла была выделена из фекалий пациентов с превдомембранозным колитом (ПМК) после лечения клиндамицином, в связи с чем и была отнесена к патогенным возбудителям. С начала ХХI века во многих странах отмечается нарастание распространенности клостридиальной инфекции. Этому обстоятельству способствует широкое применение антибиотиков во всех странах мира, рост резистентной микрофлоры, длительное пребывание в стационаре и выхаживание глубоко недоношенных новорожденных, получающих антибактериальные препараты.
МИКРОФЛОРА КИШЕЧНИКА ЗДОРОВОГО ЧЕЛОВЕКА И ПРИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЯХ
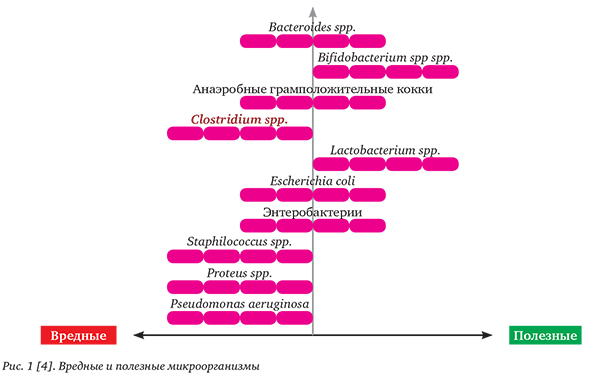
Известно, что взаимоотношение между кишечником и бактериальной микрофлорой — это сложный процесс, имеющий как положительные, так и отрицательные стороны. Кишечник человека заселен микроорганизмами — микрофлорой. Многие исследователи считают, что микрофлора является дополнительным человеческим органом, который имеет определенную массу, клеточный состав, генетическое содержание, метаболическую активность. Некоторые микроорганизмы даже в организме здорового человека способны проникать в кровоток и оказывать влияние на здоровье и функцию не только кишечника, но и всего пищеварительного тракта [3]. Состав микрофлоры конкретного человека зависит от факторов внешней среды и организма хозяина. Заселять кишечник могут многие микроорганизмы — как полезные, так и вредные (рис. 1).
К патогенным бактериям относятся: Clostridium spp., Pseudomonas aeruginosa, Staphilococcus spp., Pr...












