Урология №3 / 2015
Лечение больных простатитом доксициклином (Юнидокс Солютаб®) и/или джозамицином (Вильпрафен®) в реальной клинической практике. Результаты наблюдательной программы TAURUS
1 Кафедра урологии Первого МГМУ им. И.М. Сеченова; 2 Урологическое отделение государственной поликлиники № 180 Департамента здравоохранения г. Москвы; 3 НИИ урологии МЗ РФ; 4 Отделение урологии поликлиники № 3 Управления делами Президента РФ; 5 Урологическое отделение государственной поликлиники № 27 Департамента здравоохранения г. Москвы; 6 Отделение андрологии и урологии ФГУ «Эндокринологический научный центр»; 7 Кафедра урологии Северо-Западного Государственного медицинского университета им. И. И. Мечникова»; 8 Кафедра урологии и нефрологии Алтайского государственного медицинского университета
Терапия хронического простатита – актуальная и сложная проблема, в которой масса штампов и «трафаретных» подходов часто приводит к неизлеченности пациентов. Увеличение роли внутриклеточных микроорганизмов в этиологии простатита требует изменения стандартных назначений. Исследование TAURUS демонстрирует высокие показатели эффективности терапии хронического простатита с применением доксициклина (Юнидокс Солютаб®) и/или джозамицина (Вильпрафен®). Терапия, исследуемая в настоящей программе, по оценке врачей, была эффективной для 93,2% пациентов. Неэффективность лечения была отмечена всего у 1,3% пациентов, еще у 5,5% пациентов было недостаточно данных для проведения оценки. В процессе терапии была отмечена низкая частота нежелательных реакций. Во всей популяции нежелательные реакции возникли у 2,6% пациентов, из них серьезные – у 0,7% пациентов. Наиболее частой нежелательной реакцией во всех терапевтических группах была диарея.
Введение. Наблюдательная программа, или неинтервенционное клиническое исследование, – вид клинического исследования, в котором все клинико-диагностические процедуры и схемы лечения общеупотребительны в клинической практике и назначаются по решению лечащего врача. Наблюдательные программы нацелены на сбор данных о существующей врачебной практике, а не на исследование новых режимов терапии. Плюсом такого способа сбора материала служит возможность изучения методов диагностики и лечения, применяющихся в реальной жизни, в т.ч. в условиях поликлинической терапии, а не в камерной обстановке научно-исследовательских учреждений, что, безусловно, более масштабно и детально отражает сложившуюся клиническую ситуацию. При мультицентровом характере исследования, большом объеме выборки, адекватном статистическом анализе результатов, полученные данные – весомый аргумент в пользу того или иного положения.
Хроническое и острое воспаление простаты – наиболее часто встречающееся урологическое заболевание у мужчин в возрасте до 50 лет, тогда как у пациентов старше 50 лет оно занимает третье место по распространенности после ДГПЖ и рака простаты [1].
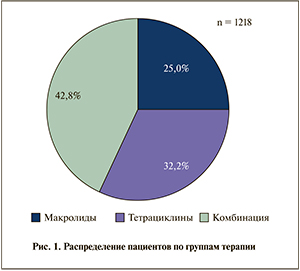 Согласно рекомендациям Европейской ассоциации урологов и Российского общества урологов, для лечения больных хроническим простатитом и/или синдромом хронической тазовой боли (ХП/СХТБ) большинство урологов назначают антимикробную терапию препаратами первого ряда (фторхинолоны) на протяжении 4 недель. Зачастую, это проводится эмпирически, без верификации первичного бактериального агента и определения его чувствительности. Оценив возможности применения традиционного бактериологического исследования и ПЦР-диагностики в протоколе обследования пациентов с хроническим простатитом, Y.S. Choi и соавт. [2] показали в 40% случаев выявление атипичных микроорганизмов (Chlamydia, Mycoplasma и Ureaplasma) в сочетании с E. coli, Ps. aerugionosa и кокковой флорой. Подобное комплексное исследование биоматериала для больных хроническим простатитом в амбулаторной практике – большая редкость, а потому адекватная терапия, как правило, не проводится, что считается причиной инверсии бактериального простатита в «абактериальный» и как следствие – неизлеченности пациента. Частое выявление C. trachomatis и U. urealyticum у пациентов с хроническим простатитом подтверждается и другими источниками [3, 4].
Согласно рекомендациям Европейской ассоциации урологов и Российского общества урологов, для лечения больных хроническим простатитом и/или синдромом хронической тазовой боли (ХП/СХТБ) большинство урологов назначают антимикробную терапию препаратами первого ряда (фторхинолоны) на протяжении 4 недель. Зачастую, это проводится эмпирически, без верификации первичного бактериального агента и определения его чувствительности. Оценив возможности применения традиционного бактериологического исследования и ПЦР-диагностики в протоколе обследования пациентов с хроническим простатитом, Y.S. Choi и соавт. [2] показали в 40% случаев выявление атипичных микроорганизмов (Chlamydia, Mycoplasma и Ureaplasma) в сочетании с E. coli, Ps. aerugionosa и кокковой флорой. Подобное комплексное исследование биоматериала для больных хроническим простатитом в амбулаторной практике – большая редкость, а потому адекватная терапия, как правило, не проводится, что считается причиной инверсии бактериального простатита в «абактериальный» и как следствие – неизлеченности пациента. Частое выявление C. trachomatis и U. urealyticum у пациентов с хроническим простатитом подтверждается и другими источниками [3, 4].
Согласно рекомендациям Европейской ассоциации урологов, при наличии непереносимости фторхинолонов, устойчивости к терапии проводится бактериологическое исследование постмассажной мочи и смена препарата в соответствии с чувствительностью (например, на триметоприм) [5]. По данным F. Wagenlehner, обследовавшего и лечившего в 2011 г. 243 пациента с хроническим простатитом, эффективность приема ципрофлоксацина была отмечена у 93,5% [6]. Однако, T. Cai и соавт. при сравнении динамики выявленных за последние 10 лет уропатогенов, отметили снижение роли кишечной палочки и увеличение роли энтерококка в этиологии хронического простатита, а также снижение чувствительности микрофлоры к ципрофлоксацину [7]. В свою очередь, E. Vicari [8] сообщил, что у половины пациентов при исследовании секрета простаты были выделены штаммы микоплазм (U. urealyticum и M. hominis), 59,5% которых характеризовались высокой резистентностью к ципрофлоксацину, тогда как показатели устойчивости к доксициклину и джозамицину были наименьшими (0,0–1,7%). Низкая чувствительность микоплазм к офлоксацину и эритромицину (29,4 и 54,8%) была показана в исследовании Z.H. Yan и соавт., в то время как чувствительность их к доксициклину, пристинамицину, джозамицину и тетрациклину сохранялась на уровне 94,3%, 96,6, 86,5 и 97,4% соответственно [9]. Таким образом, препаратом первой линии по-прежнему считаются фторхинолоны, а триметоприм, макролиды и тетрациклины применяются в лечении хронического простатита лишь как альтернативные препараты. Г.А. Восканян и соавт. в 2014 г. в своем обзоре литературы [10], посвященном современному видению консервативной терапии хронического простатита, говорят о необходимости поиска новых индивидуальных подходов к терапии простатита и оценке ее эффективности с учетом длительности заболевания и возможности микст-инфицирования атипичными возбудителями.
Затруднения в адекватном индивидуальном выборе антибактериального препарата для лечения больных хроническим простатитом, упрощенное назначение эмпирического лечения, конечно же, делают последнее более привлекательным для врача. Добавим к этому низкую комплаентность пациентов к терапии, большой риск микст-инфекций, невысокий уровень санитарно-гигиенической культуры населения (необязательность обследования полового партнера и использования средств барьерной контрацепции, лечение партнеров одними и теми же препаратами, отсутствие контрольного обследования после терапии), экономические (высокая стоимость препаратов и молекулярно-биологических методов диагностики при низких доходах, необходимость оплачивать курсы физиотерапевтических воздействий) и поведенческие факторы (наличие нескол...












