Терапия №3 (13) / 2017
Лекарственные взаимодействия противовирусных препаратов прямого действия при лечении хронического вирусного гепатита С
ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», кафедра пропедевтики внутренних болезней и гастроэнтерологии, г. Москва
В последнее время в России отмечается активизация эпидемической ситуации по гепатиту С (ГС). Отмечен рост показателей заболеваемости хроническим ГС (ХГС) с 31,8 случаев на 100 тыс. населения в 2005 г. до 39,9 в 2011 г., часто поражаются лица молодого возраста, имеет место высокий уровень хронизации с возможным исходом в цирроз и первичный рак печени. Процессы на основных этапах жизненного цикла вируса ГС являются главными мишенями при разработке препаратов для лечения ХГС. Лечение показано всем больным ГС с компенсированным и декомпенсированным хроническим поражением печени, ранее получавшим или не получавшим терапию, готовым получать ее и не имеющим противопоказаний. До 2011 г. официально рекомендованным методом лечения ХГС было применение комбинации пегилированного интерферона-α и рибавирина в течение 24 или 48 нед. После одобрения в 2014 г. в Европе трех новых противовирусных препаратов прямого действия для терапии ХГС широкое применение получили безинтерфероновые схемы лечения. Эти схемы использовались преимущественно для лечения пациентов с тяжелым поражением печени (фиброз 3–4-й стадии по шкале METAVIR). Комбинирование препаратов требуют осторожного использования и коррекции дозы, чередования по времени приема, дополнительного мониторинга. Лекарственные взаимодействия особенно следует учитывать при выборе комплексной терапии при коинфекции вируса ГС и ВИЧ.
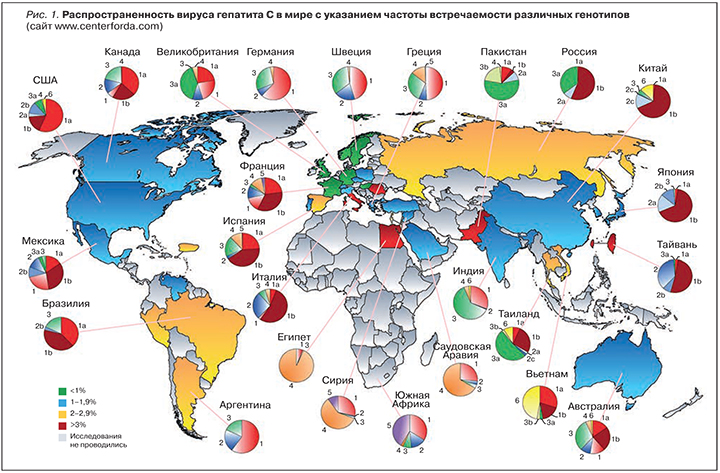
У вируса гепатита С (ГС) выделяют 7 основных генотипов, по-разному распространенных в регионах мира [1]. Первое место по распространенности занимает генотип 1 – на него приходится почти половина всех диагностированных случаев заражения. Он преобладает в Европе, Северной Америке и Австралии. Самый распространенный подтип этого генотипа – 1b, на него приходится до 22% всех случаев заражения. Второй по встречаемости генотип 3 характерен для стран Азии (Индия, Пакистан, Бангладеш и др.) [2]. Третье место делят генотипы 2 и 4 [3]. Эпидемиология хронического ГС (ХГС) представлена на рис. 1.
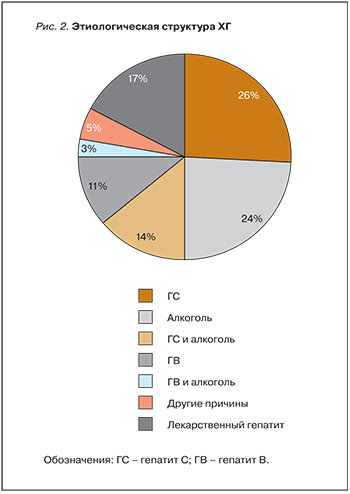
Вирусный ГС занимает лидирующее место в сравнении с алкогольными, лекарственными и другими гепатитами (рис. 2) [4]. Он является одной из основных причин цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) во всем мире. Глобальная распространенность вируса ГС (HCV) среди населения составляет 2,8%, что соответствует 185 млн инфицированных [5]. В Европейском союзе смертность, связанная с вирусными гепатитами, приблизительно в 10 раз больше, чем от вируса иммунодефицита человека (ВИЧ). Две трети смертей от вирусных гепатитов связанны с ГС. Аналогичные данные были зарегистрированы в США, где связанная с ГС смертность превысила таковую от ВИЧ в 2007 г. [6].
 В последнее время в России отмечается активизация эпидемической ситуации по ГС. Отмечен рост показателей заболеваемости ХГС с 31,8 случая на 100 тыс. населения в 2005 г. до 39,9 – в 2011 г. [7], часто поражаются лица молодого возраста, имеет место высокий уровень хронизации с возможным исходом в ЦП и ГЦК.
В последнее время в России отмечается активизация эпидемической ситуации по ГС. Отмечен рост показателей заболеваемости ХГС с 31,8 случая на 100 тыс. населения в 2005 г. до 39,9 – в 2011 г. [7], часто поражаются лица молодого возраста, имеет место высокий уровень хронизации с возможным исходом в ЦП и ГЦК.
У 75% пациентов, инфицированных HCV, развивается ХГС. От 20 до 40% пациентов с ХГС страдают ЦП, и у них с частотой 1–4% случаев в год возникает ГЦК. У пациентов с ЦП также отмечаются осложнения портальной гипертензии, которые могут проявляться асцитом, гиперспленизмом и внутренним кровотечением [8].
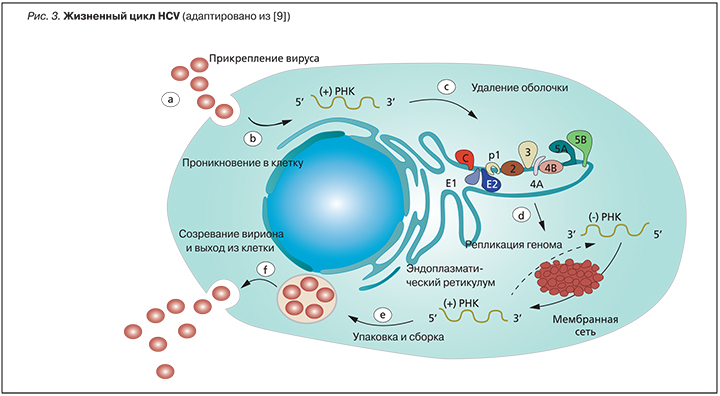
HСV – член семейства флавивирусов. Геном HСV представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. HСV вызывает заболевание только у человека. По внешним параметрам это обычный мелкий сферический вирус, имеющий оболочку. У HСV очень маленький геном, в нем всего один ген, в котором зашифрована структура 9 белков. Эти белки участвуют в проникновении вируса в клетку, создании и сборке вирусных частиц, переключении на себя некоторых функций клетки. Три белка вируса, участвующие в формировании вирусной частицы, называются структурными, остальные шесть белков выполняют разные ферментативные функции и носят название неструктурных. Схематично жизненный цикл HСV представлен на рис. 3.
ДИАГНОСТИКА ГЕПАТИТА С
С целью диагностики ГС и мониторирования HСV-инфицированных пациентов используются следующие лабораторные методы:
- Серологические – определение специфических анти-HСV класса IgG или суммарных IgG и IgМ иммунохимическими методами: ИФА, иммунохемилюминесценция, иммуноблоттинг и т.д. Диагностика проводится с использованием скрининговых и подтверждающих наборов реагентов. В подтверждающем тесте, как правило, проводится определение антител к индивидуальным белкам HСV – core, NS3, NS4, NS5 методом ИФА или иммуноблоттинга.
- Молекулярные – в диагностике ГС используются качественные тесты, позволяющие выявить РНК HСV; количественные тесты, оценивающие степень вирусной нагрузки; генотипирующие тесты, позволяющие определить генотип (субтип) HСV. Основным молекулярно-биологическим методом, используемым в современной диагностике, является ПЦР, в т.ч. ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени, которая используется для проведения качественных и количественных тестов.
- Генотипирование HСV, которое должно выполняться всем пациентам до начала противовирусной терапии (ПВТ) в целях планирования ее продолжительности, эффективности, в отдельных случаях – расчета дозы противовирусных препаратов.
- Определение генотипа пациента по совокупности аллельных вариантов однонуклеотидных полиморфизмов rs12979860 и rs8099917 в гене интерлейкина 28В (IL28В), который, по данным проведенных исследований, для пациентов с генотипом 1 HСV служит надежным предиктором достижения устойчивого вирусологического ответа (УВО) на фоне проведения двойной и тройной ПВТ.
Следует отметит, что определение генотипа IL28B потеряло свое прогностическое значение с появлением новых эффективных безинтерефероновых схем терапии. Теперь генотипирование IL28B используется исключительно в тех случаях, когда доступны только пегилированный интерферона-α (PegIFN-α) и рибавирин, или для того, чтобы выбрать экономически выгодные схемы лечения при ограниченных экономических ресурсах.












