Акушерство и Гинекология №7 / 2024
«Маска» туберозного склероза – генитальный эндометриоз
1) ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии имени Д.О. Отта», Санкт-Петербург, Россия;
2) ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Минздрава России, Санкт-Петербург, Россия;
3) ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, Санкт-Петербург, Россия
Актуальность: Туберозный склероз (ТС) – орфанное наследственное заболевание, характеризующееся образованием доброкачественных опухолей во многих системах и органах. Причиной развития данной патологии являются мутации в генах TSC1 и TSC2, которые отвечают за кодирование белков гамартина и туберина, регулирующих клеточный рост в различных органах и тканях организма.
Описание: Представлено описание клинического случая ТС у девочки 12 лет. Пациентка обратилась с жалобами на дисменорею с периода менархе, а также наличием одного оперативного вмешательства в анамнезе по поводу кистозного образования тела матки и распространенного эндометриоза малого таза. В ходе дальнейшего углубленного обследования и диагностического поиска с привлечением врачей различных специальностей из нескольких ведущих учреждений, сопоставив клиническую картину, результаты инструментальных и лабораторных обследований, а также генетического тестирования, в ходе которого была выявлена мутация в гене TSC1, пациентке был поставлен диагноз ТС. Особенностью данного клинического наблюдения явилось отсутствие ярких клинических критериев заболевания, таких как поражения кожи, эпилептические припадки, поражение центральной нервной системы и схожесть симптоматики с клиническими проявлениями эндометриоза. Это стало причиной задержки в постановке верного диагноза и назначения лечения.
Заключение: Данный клинический пример может быть полезен для врачей различных специальностей, так как для своевременной диагностики и лечения таких пациентов необходимо соблюдение принципов мультидисциплинарного подхода.
Вклад авторов: Ярмолинская М.И., Кохреидзе Н.А. – концепция и план исследования, анализ данных и выводы; Ярмолинская М.И., Кохреидзе Н.А., Комличенко Э.В., Леонтьева С.А., Колошкина А.В. – сбор данных; Ярмолинская М.И., Кохреидзе Н.А., Колошкина А.В. – подготовка рукописи.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Работа выполнена без спонсорской поддержки.
Согласие пациентов на публикацию: Получено информированное согласие матери несовершеннолетней девочки на публикацию данных и изображений пациентки.
Для цитирования: Ярмолинская М.И., Кохреидзе Н.А., Комличенко Э.В., Леонтьева С.А., Колошкина А.В. «Маска» туберозного склероза – генитальный эндометриоз.
Акушерство и гинекология. 2024; 7: 177-186
https://dx.doi.org/10.18565/aig.2024.120
Туберозный склероз (ТС) – это генетически детерминированное заболевание из группы факоматозов, которое характеризуется образованием гамартом – доброкачественным разрастанием зрелых клеток и тканей, нормальных для данной локализации. Данное заболевание может проявляться в любом возрасте и поражать различные системы и органы, преимущественно кожу, головной мозг, глаза, почки и сердце [1]. Частота ТС в популяции составляет 1:10 000 (у новорожденных – 1:6000). Расчетное число больных ТС в Российской Федерации около 7000 человек, поэтому ТС относится к редким (орфанным) заболеваниям [2].
Чаще всего ТС диагностируется в детском возрасте на основании характерных поражений кожи, судорог и избыточного клеточного роста или гамартом в сердце, головном мозге и почках. При тяжелом течении заболевание может приводить к сокращению продолжительности жизни и инвалидизации пациентов [3].
ТС вызывается мутациями в генах TSC1 или TSC2. TSC1 обнаружен на хромосоме 9q34 и кодирует белок гамартин, TSC2 обнаружен на хромосоме 16p13 и кодирует белок туберин. Как гамартин, так и туберин являются белками-супрессорами клеточного роста и широко экспрессируются в тканях организма. Они являются частью мишени сигнального пути рапамицина млекопитающих (mTOR), который регулирует клеточный рост, размеры клеток и степень пролиферации. В результате мутации комплекс TSC2:TSC1 блокирует активацию сигнального пути, что ведет к избыточному разрастанию ткани (рис. 1) [1]. В результате этого наблюдается дисфункция клеточной дифференцировки, пролиферации и миграции в период раннего развития плода, что ведет к образованию опухолей, состоящих из глиально-нейрональных клеток, а также гамартом сетчатки, субэпендимальных гигантоклеточных опухолей, рабдомиом сердца, почечных и внепочечных ангиомиолипом и легочного лимфангиолейомиоматоза [4].
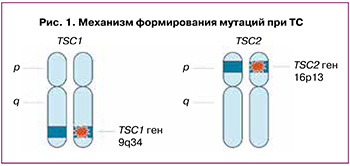
Известно, что примерно 30% случаев ТС наследуются по аутосомно-доминантному типу, а в 70% ТС возникает вследствие спонтанной мутации (de novo). Мутации в гене TSC2 в 4 раза чаще встречаются в случаях de novo; однако при семейных случаях заболевания ТС встречаемость мутаций в гене TSC1 и в гене TSC2 примерно сопоставимы [1, 2]. Важно отметить, что мутации в этих генах характеризуются вариабельной экспрессивностью, поэтому у родственников с одинаковой мутацией заболевание может протекать с разной степенью тяжести [3].
Выделяют ТС 1 типа – при выявлении мутации в гене TSC1 и ТС 2 типа – при мутации в гене TSC2. Есть данные о менее выраженном течении и более благоприятном прогнозе заболевания при мутации в гене TSC1 [5].
Для подтверждения диагноза ТС необходима идентификация патогенной мутации в генах TSC1 или TSC2 с помощью молекулярно-генетического тестирования, а также необходимо наличие двух больших критериев или одного большого критерия в совокупности с, как минимум, двумя малыми критериями. Большие и малые критерии представлены в таблице [1].
Классическая картина ТС включает поражения кожи, эпилептические припадки и задержку развития. Однако неявная клиническая картина или ее отсутствие при ТС объясняют сложности своевременной диагностики и приводят к поздней постановке правильного диагноза. Кроме того, в 10–25% случаев мутации сложно выявить при стандартном исследовании, так как они могут быть представлены в мозаичной форме или располагаться в интронах [6].
Клиническое наблюдение
Пациентка П., 12 лет, впервые обратилась в Центр «Диагностики и лечения эндометриоза» ФГБНУ «НИИ им. Д.О. Отта» для определения дальнейшей тактики после оперативного лечения по поводу кистозного образования тела матки.
Из анамнеза известно, что девочка родилась от первой беременности у здоровой молодой матери. Беременность протекала с явлениями угрозы прерывания в сроке 10 недель. Роды неосложненные, вес новорожденной – 2570 г, рост – 48 см. При рождении на правой ноге отмечены выраженное лануго, пятна витилиго на правой конечности, спине, лице. Росла и развивалась нормально до 4 лет. В 4 года возникло необъяснимое медленно прогрессирующее увеличение длины правой бедренной кости, появилась хромота, возникла угроза вывиха правого коленного сустава. Диагностирована дисплазия костей правой конечности (рис. 2). В 9 лет проведено оперативное лечение – резекция бедренной кости, установка пластины, в 10 лет (2020 г.) – удаление пластины. Наследственность – у двоюродного брата по материнской линии гемофилия А.
Менструации с 12 лет, регулярные по 6 дней через 28 дней. Менархе резко болезненные, сопровождались дурнотой. Степень выраженности болей – до «не могла двигаться», пропускала школу. В том же году, в возрасте 12 лет, была экстренно госпитализирована в стационар с диагнозом «киста левого яичника с болевым синдромом», проведено симптоматическое лечение, после выписки наблюдалась гинекологом с сохраняющимися жалобами на выраженную дисменорею (10 баллов по визуально-аналоговой шкале ...












