Фарматека №9 (362) / 2018
Микробиота, метаболический синдром, психо-интеллектуальное функционирование: грани патогенетической сопряженности
1) Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия;
2) Санкт-Петербургский государственный педиатрический медицинский университет, Санкт-Петербург, Россия
В статье представлены результаты анализа современной научной медицинской литературы, посвященной взаимосвязи между микробиотой и метаболическим синдромом, их влиянию на психоинтеллектуальный статус пациентов. Учитывая то, что на нервную систему и психо-интеллектуальное функционирование негативно влияют как сигнальные молекулы, вырабатываемые микробиотой, так и собственно метаболические нарушения, целесообразно рассмотрение данных нарушений в рамках единого патологического процесса с общими клинико-патогенетическими звеньями. Интегративный подход к указанной комплексной патологии в рамках современных тенденций развития медицинской науки будет способствовать более адекватному и эффективному ведению больных данной категории.
Осознание значимости влияния микробиоты на здоровье человека приходит в современную медицину постепенно. Организм человека представляет собой «суперорганизм», включающий симбиотическое сообщество многочисленных эукариотических, прокариотических клеток, вирусов и архибактерий. «Метагеном» данного «суперорганизма» состоит из генов собственно Homo sapiens и генов (микробиом), присутствующих в геномах микроорганизмов, населяющих тело человека [1, 2]. На сегодняшний день убедительно доказано, что в организме взрослого человека находится около 100 трлн бактерий и более квадриллиона вирусов, что в 10–100 раз превышает общее число его соматических и зародышевых клеток [2–8]. В то же время нельзя не отметить, что в организме человека все функции прямо или опосредованно связаны с активностью колонизирующих его многочисленных микроорганизмов [2, 5–8].
Например, накоплены данные, что микробиота наряду с морфофункциональной адаптацией желудочно-кишечного тракта влияет на процессы созревания иммунной системы и формирует ось взаимодействия кишечник–мозг (центральная нервная система [ЦНС]; рис. 1).
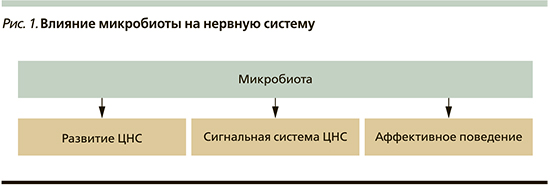
Известно, что синтетическая активность микробиоты по продукции разнообразных сигнальных молекул (регуляторные амины, пептидные нейромодуляторы) заслуженно находится на втором месте после собственно мозговой ткани [9]. Продукция нейротрансмиттеров микробиотой происходит в количествах, нередко превышающих содержание этих соединений в сыворотке крови человека. Многие исследователи едины во мнении, что симбиотическая кишечная микробиота способна активно участвовать в накоплении общего пула соответствующих нейромедиаторов и как следствие – в регуляции нервно-психической деятельности млекопитающих [2, 10, 11].
Влияние микробиоты на нервную систему происходит с помощью нескольких механизмов, в т.ч. посредством продукции значительного количества сигнальных молекул и короткоцепочечных жирных кислот (КЦЖК), которые участвуют в модуляции экспрессии генов путем подавления деацетилирования гистоновых белков и обладают разными значимыми эффектами на функционирование ЦНС (табл. 1, 2) [12].

К КЦЖК относятся кислоты, содержащие 2, 3, 4 и 5 атомов углерода – ацетат, пропионат, бутират и пентаноат, образующиеся в результате микробной ферментации сложных полисахаридов (крахмалы и пищевые волокна) в толстой кишке. КЦЖК через портальную циркуляцию попадают в кровоток и далее транспортируются в органы и ткани, участвуя в процессах регуляции и обеспечивая межклеточное взаимодействие, включая регуляцию экспрессии генов [13, 14]. Такие КЦЖК, как пропионат и бутират, способны модулировать функциональную активность головного мозга, участвуя в контроле над аппетитом и поддержании энергетического гомеостаза через регуляцию продукции нейропептидов [15]. При этом бутират преимущественно абсорбируется на поверхности кишечного эпителия, тогда как ацетат и пропионат попадают в системную циркуляцию [16].
В целом суммируя накопленные данные, ниже представлены механизмы взаимодействия микробиоты и ЦНС:












