Кардиология №7 / 2016
Минеральная плотность костной ткани и костный обмен при хронической сердечной недостаточности
1ГБОУ ВПО Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздрава РФ, Москва; 2ГБУЗ Диагностический клинический центр №1 Департамента здравоохранения г. Москвы
Изучение коморбидных состояний при хронической сердечной недостаточности (ХСН) привлекает все большее внимание, поскольку они способны не только затруднять диагностику, но и провоцировать прогрессирование основного заболевания. Остеопороз (ОП) является одним из таких заболеваний, которое в настоящее время встречается более чем у 200 млн человек в мире [1]. Пожилой возраст, малоподвижный образ жизни, курение, неконтролируемая артериальная гипертензия (АГ), сахарный диабет (СД), хроническая почечная недостаточность объединяют эти патологические состояния. ХСН и ОП — хронические неинфекционные заболевания с высокой распространенностью и развитием тяжелых осложнений в виде декомпенсации при ХСН и переломов при ОП, приводящих к госпитализации, инвалидности и преждевременному летальному исходу. Образ жизни, отношение больного к своему заболеванию и лечению, наследственность, факторы окружающей среды и возрастные изменения влияют на развитие указанных осложнений.
В российской и зарубежной литературе имеются единичные работы, посвященные изучению костного обмена у больных ХСН. В основном изучается костный обмен у больных ХСН в терминальной стадии заболевания, ожидающих пересадку сердца [2—4]. Практически отсутствуют работы, в которых обследование амбулаторных больных ХСН с нарушением костного обмена было комплексным и всесторонним с определением структурно-функционального состояния сердца и метаболизма костной ткани. Понимание механизмов снижения минеральной плотности костной ткани (МПКТ) в целом и при ХСН в частности, своевременное выявление факторов риска прогрессирования как ОП, так и ХСН помогут врачу оптимизировать ведение больных на поликлиническом этапе.
Цель настоящего исследования — оценка МПКТ и состояния костного обмена у амбулаторных больных ХСН.
Материал и методы
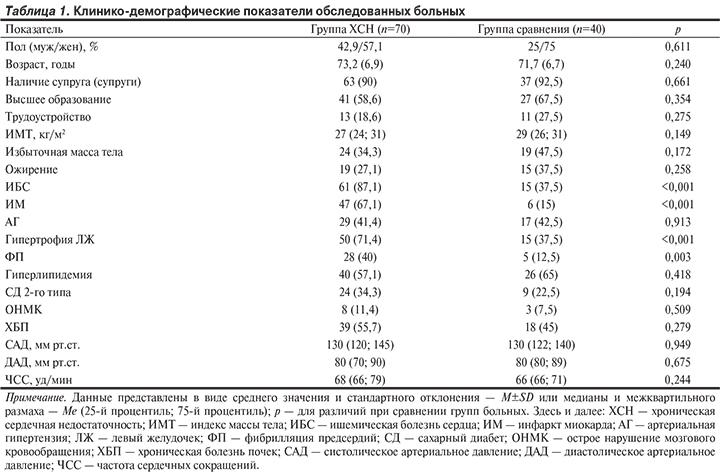
В открытое сравнительное проспективное исследование были включены 70 больных ХСН (30 мужчин, 40 женщин) в возрасте от 56 до 88 лет. Критерии включения в исследование: 1) возраст 50 лет и старше; 2) ХСН II—IV функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA) вследствие ишемической болезни сердца (ИБС) и/или АГ, диагностированная не менее чем за 6 мес перед включением в исследование; 3) стабильное течение заболевания, отсутствие госпитализаций по поводу декомпенсации ХСН в течение предшествующих 3 мес; 4) отсутствие изменений в медикаментозной терапии ХСН в течение 1 мес до включения в исследование; 5) согласие пациента на добровольное участие в исследовании. Критерии исключения: 1) наличие хронических заболеваний, воздействующих на костный метаболизм: аутоиммунные и онкологические заболевания, миеломная болезнь и другие гематологические заболевания, тяжелая печеночная недостаточность, гиперфункция щитовидной железы, синдром Кушинга, хроническая обструктивная болезнь легких, бронхиальная астма, ревматоидный артрит и другие заболевания, требующие назначения системных или ингаляционных глюкокортикостероидных препаратов; 2) уровень креатинина в сыворотке крови >221 мкмоль/л (2,5 мг/дл), гемодиализ; 3) сопутствующая или в прошлом терапия бисфософонатами, кальцитонином, эстрогенами, глюкокортикостероидами, препаратами витамина D или кальция; 4) инфаркт миокарда (ИМ), острое нарушение мозгового кровообращения (ОНМК) в течение последних 3 мес перед исследованием, ревматические пороки сердца, инфекционный эндокардит.
Диагноз ХСН устанавливали в соответствии с Российскими национальными рекомендациями по диагностике и лечению ХСН. Для оценки общего состояния больных и выраженности клинических проявлений ХСН использовали «Шкалу оценки клинического состояния» (ШОКС) [5]. Причиной ХСН у 47 (67,1%) больных была ИБС, а у 23 (32,9%) — АГ. Перенесенный ИМ осложнился развитием хронической аневризмы левого желудочка (ЛЖ) у 18 (25,7%) больных. Аортокоронарное шунтирование и транслюминальная баллонная ангиопластика со стентированием проводились 10 (14,3%) больным, имплантированный электрокардиостимулятор имелся у 4 (5,7%). ХСН II ФК констатирована у 39 (55,7%) больных, III ФК — у 31 (44,3%). Медиана длительности ХСН составила 3 года (от 0,5 до 7 лет). В группу сравнения вошли 40 больных (10 мужчин, 30 женщин) в возрасте от 57 до 88 лет с сердечно-сосудистыми заболеваниями — ССЗ (АГ, ИБС, стабильная стенокардия напряжения, нарушения ритма сердца и др.) без ХСН. У всех обследованных пациентов этой группы отсутствовали жалобы на одышку при физической нагрузке и в покое, утомляемость. По данным электрокардиографии и эхокардиографии (ЭхоКГ) систолическая дисфункция желудочков сердца отсутствовала — фракция выброса (ФВ) левого желудочка (ЛЖ) ≥50%. Больные группы сравнения получали такую же медикаментозную терапию, как для лечения ХСН (ингибиторы ангиотензинпревращающего фермента — АПФ, антагонисты рецепторов ангиотензина II — АРАII, β-адреноблокаторы, антагонисты минералокортикоидных рецепторов, диуретики). Медиана длительности ССЗ у больных этой группы составила 3 года (от 1 года до 5 лет).Все сопутствующие хронические ...












