Кардиология №7 / 2014
Мочевая кислота и факторы кардиометаболического риска при артериальной гипертензии у подростков
ФГБУ Научный центр проблем здоровья семьи и репродукции человека СО РАМН, 664003, Иркутск, ул. Тимирязева, 16
Наличие тесной взаимосвязи между метаболическими нарушениями и сердечно-сосудистыми заболеваниями в настоящее время считается доказанным, и все чаще обсуждается кардиометаболический континуум, под которым подразумевают патогенетическую общность обменной и сердечно-сосудистой патологии. Так, артериальная гипертензия (АГ), осложнения которой служат основной причиной инвалидности и смертности населения трудоспособного возраста, входит в кластер компонентов метаболического синдрома (МС), распространенность которого растет с эпидемической скоростью не только во взрослой популяции, но и среди детей и подростков [1].
В то же время следует отметить, что концепция МС в педиатрии является весьма спорной. Отсутствуют утвержденная дефиниция МС для педиатрической когорты, диагностические критерии МС, используемые в педиатрических исследованиях, вариативно адаптированы из взрослых стандартов с использованием половых и возрастных норм. Такой ситуации, несомненно, способствует то, что нарушения метаболических показателей у большинства детей количественно умеренные; инсулинорезистентность (ИР), которая считается краеугольным камнем концепции МС, является физиологическим состоянием периода полового созревания, стабильность компонентов МС, особенно у подростков, низка [1]. Следовательно, применительно к детскому возрасту будет более уместным говорить о факторах кардиометаболического риска (КМР), т.е. факторах, которые могут играть роль в возникновении как сердечно-сосудистой, так и обменной патологии. К таким факторам традиционно относят абдоминальное ожирение, АГ, дислипидемию (ДЛП) и гипергликемию натощак/после приема пищи [2].

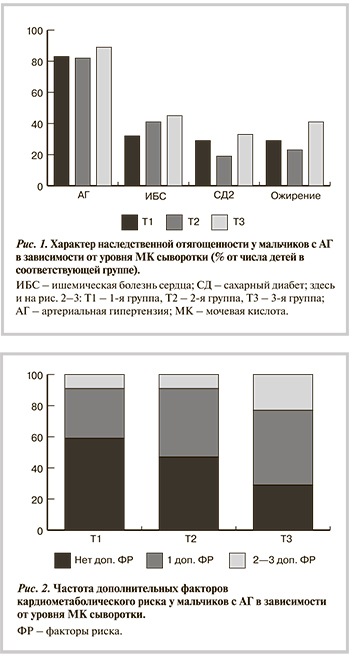
В последних исследованиях показано, что важную роль в кардиометаболическом континууме играет мочевая кислота (МК) [3—7], однако то, каким образом осуществляется ее взаимодействие с другими факторами КМР, остается предметом дискуссии. Представляется, что изучение связи сывороточных концентраций мочевой кислоты (СКМК) с факторами КМР в когорте молодых людей одного пола, не отягощенных сочетанием ассоциированных с возрастом соматических проблем, является интересной и перспективной задачей.
Материал и методы
 В исследование был последовательно включен 261 мальчик в возрасте 12—18 лет (средний возраст 15,8±1,3 года) из числа детей, направленных в Клинику ФГБУ «НЦ ПЗСРЧ» СО РАМН для обследования по поводу повышенного уровня артериального давления (АД). Ни один из пациентов не получал лекарственных препаратов, которые могли бы влиять на уровни МК, липидов и глюкозы в сыворотке крови, также ни один из подростков на момент обследования и в течение по меньшей мере 2 мес до него не получал антигипертензивной терапии. Больные с симптоматической АГ и с любой почечной патологией в исследование не включались.
В исследование был последовательно включен 261 мальчик в возрасте 12—18 лет (средний возраст 15,8±1,3 года) из числа детей, направленных в Клинику ФГБУ «НЦ ПЗСРЧ» СО РАМН для обследования по поводу повышенного уровня артериального давления (АД). Ни один из пациентов не получал лекарственных препаратов, которые могли бы влиять на уровни МК, липидов и глюкозы в сыворотке крови, также ни один из подростков на момент обследования и в течение по меньшей мере 2 мес до него не получал антигипертензивной терапии. Больные с симптоматической АГ и с любой почечной патологией в исследование не включались.
АГ была верифицирована при повторных офисных измерениях и при суточном мониторировании уровня АД Условием включения в исследование было наличие средних уровней систолического АД (САД) и/или диастолического АД (ДАД) выше 90-го процентиля для данного возраста, пола и роста [3] и значений индексов нагрузки повышенным САД и/или ДАД выше 25% за любой период суток. Так как исследуемая группа состояла из детей разного возраста, средние уровни АД за каждый период суток были ранжированы как нормальное АД (10—89-й процентиль для данного возраста, пола и роста), повышенное нормальное АД (90—94-й процентиль или ≥120/80 мм рт.ст.) и высокое АД (95-й процентиль и выше или ≥140/90 мм рт.ст.). Алгоритм программы предусматривал также расчет показателей вариабельности АД (стандартное отклонение от средней величины и коэффициент вариации) и суточных индексов, характеризующих степень снижения АД к ночи.
 Всем детям проводили измерение линейного роста и массы тела (МТ) с последующим вычислением индекса массы тела (ИМТ). Его оценивали индивидуально по нормативам для конкретного возраста и пола; ИМТ был представлен в виде числа стандартных отклонений от среднего (SDS). Диагностическим критерием избыточной МТ считался SDS ИМТ >1,5, но <2; диагностическим критерием ожирения считался SDS ИМТ ≥2,0.
Всем детям проводили измерение линейного роста и массы тела (МТ) с последующим вычислением индекса массы тела (ИМТ). Его оценивали индивидуально по нормативам для конкретного возраста и пола; ИМТ был представлен в виде числа стандартных отклонений от среднего (SDS). Диагностическим критерием избыточной МТ считался SDS ИМТ >1,5, но <2; диагностическим критерием ожирения считался SDS ИМТ ≥2,0.
Определение концентрации глюкозы в сыворотке крови натощак проводили глюкозооксидазным методом с помощью наборов Новоглюк-К, М. СКМК, уровни общего холестерина (ХС), три-глицеридов (ТГ) и ХС липопротеидов высокой плотности (ЛВП) определяли с помощью ферментативного колориметрического метода, используя диагностические наборы, фотометр BTS-330. Уровень ХС липопротеидов низкой плотности (ЛНП) рассчитывали по формуле Фридвальда.
При определении пороговых уровней липидов и глюкозы мы ориентировались на критерии, предложенные педиатрической группой IDF (2007 г.) [4]. Уровень общего ХС считали повышенным при его содержании в сыворотке ≥5,2 ммоль/л, ТГ ≥1,7 ммоль/л, ХС ЛВП <1,03 ммоль/л, ХС ЛНП ≥3,36 ммоль/л, глюкозы натощак ≥5,6 ммоль/л.
В связи с тем что не существует общепринятых нормати...












