Фарматека №17 (290) / 2014
Молекулярно-генетическая гетерогенность меланомы кожи и ее значение для разработки индивидуальных подходов к лечению
ФГБНУ «РОНЦ им. Н.Н. Блохина», Москва
Метастатическая меланома кожи характеризуется неблагоприятным прогнозом заболевания. Химиотерапия при метастатической и неоперабельной меланоме кожи до сих пор остается непростой задачей. Эффективность однокомпонентных режимов (монохимиотерапия) не превышает 10–15%. Некоторое улучшение выживаемости без прогрессирования, наблюдаемое при проведении полихимиотерапии, к сожалению, не оказывает влияния на общую выживаемость пациентов. Перспективным направлением увеличения эффективности терапии и общей продолжительности жизни больных метастатической меланомой кожи является индивидуализация лекарственного лечения, включающая определение молекулярно-генетических изменений в опухоли и назначение терапии с учетом полученных результатов. В данной статье рассматриваются современные возможности лечения с использованием новых перспективных таргетных препаратов.
Меланома кожи (МК) – это опухоль нейроэктодермального происхождения, возникающая в результате злокачественной трансформации меланоцитов, расположенных преимущественно в коже. В 2012 г. в РФ было выявлено 8639 новых случаев МК, при этом каждый четвертый (24,5%) пациент на III и IV стадиях заболевания. Так, за 10 лет (с 2002 по 2012 г.) прирост заболеваемости составил 20,7%, что говорит о росте заболеваемости и еще раз подчеркивает актуальность исследований в данной области. Помимо кожной формы меланомы, на долю которой приходится более 90%, существуют также внекожные формы опухоли, к которым относят меланому слизистых, оболочек головного и спинного мозга, глазную меланому. Все эти формы меланомы обладают различными молекулярными портретами и отличаются между собой как по прогнозу, так и по вариантам персонализированной терапии. На сегодняшний день имеются данные о наличии активирующих мутаций при всех этих видах меланомы; так, для МК любой локализации характерно наличие мутаций в генах: BRAF (50%), NRAS (20%); при акральной локализации опухоли возможно также наличие мутации в гене c-KIT (15%); при меланоме слизистых оболочек – c-KIT (20%), NRAS (15%), BRAF (5%); при глазной форме меланомы наиболее часто встречаются мутации GNAQ и GNA11 (по данным разных авторов: ~45% в первичной опухоли, ~22% в метастазах, ~30% в первичной опухоли, ~57% в метастазах соответственно). Мутации GNAQ и GNA11 не встречаются при кожной форме меланомы [1]. Все эти активирующие мутации являются потенциальными мишенями для создания новых препаратов.
 Метастатическая меланома кожи (мМК) характеризуется неблагоприятным прогнозом заболевания. Так, медиана общей выживаемости (ОВ) пациентов с мМК варьируется от 6 до 9 месяцев, по данным разных авторов [2–5]. Если при I стадии заболевания 5-летняя выживаемость превышает 90%, то при II стадии составляет около 65%, при локально-региональной (III стадии) снижается до 45%, а при метастатической (IV стадия) не превышает 10%.
Метастатическая меланома кожи (мМК) характеризуется неблагоприятным прогнозом заболевания. Так, медиана общей выживаемости (ОВ) пациентов с мМК варьируется от 6 до 9 месяцев, по данным разных авторов [2–5]. Если при I стадии заболевания 5-летняя выживаемость превышает 90%, то при II стадии составляет около 65%, при локально-региональной (III стадии) снижается до 45%, а при метастатической (IV стадия) не превышает 10%.
До недавнего времени для лечения метастатических форм МК, неоперабельной III и IV стадий заболевания, использовалась химиотерапия. Спектр цитостатиков, применяемых как в однокомпонентных, так и в многокомпонентных химиотерапевтических режимах, в основном представлен алкилирующими агентами: производными имидазолкарбоксамида (дакарбазин, темодал), производными нитрозомочевины (ломустин, фотемустин), препаратами платины (цисплатин и карбоплатин), а также таксанами (паклитаксел) или их комбинациями [6, 7]. Эффективность однокомпонентных режимов (монохимиотерапия) не превышает 10–15%. Некоторое улучшение выживаемости без прогрессирования, наблюдаемое при проведении химиотерапии, к сожалению, не оказывало влияния на ОВ пациентов. Все это делало мМК практически неизлечимой болезнью и побуждало к проведению все новых и новых клинических исследований.
В период с 1970 по 2010 г. было проведено более 3000 (3337 – PubMed; критерий поиска: «melanoma clinical trial») клинических исследований при меланоме, и ни один из исследуемых препаратов/режимов не продемонстрировал увеличения ОВ пациентов вплоть до 2011 г., когда благодаря исследованиям в области молекулярной биологии и иммунологии опухолей появилось два новых класса лекарственных препаратов: ингибиторы регуляторных молекул ключевых этапов иммунного ответа (CTLA4, PD1, PD-L1) и ингибиторы тирозинкиназных рецепторов (BRAF, MEK, NRAS) [7].
Первые значительные успехи в лечении МК, как уже было отмечено, произошли в 2011 г., когда FDA (Управление по контролю качества пищевых продуктов и лекарственных средств) зарегистрировало в США ипилимумаб (anti-CTLA4 – цитотоксический антиген Т-лимфоцита-4) и вемурафениб (BRAFi – ингибитор BRAF) для лечения диссеминированной МК. Оба препарата впервые продемонстрировали достоверное увеличение общей выживаемости пациентов с мМК по сравнению со стандартной химиотерапией.
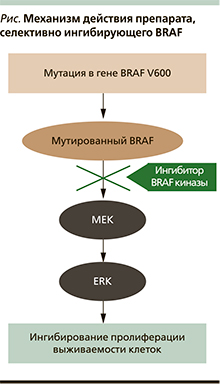
В 2002 г. исследователи института по изучению генома Sanger Institute (Великобритания) обнаружили, что приблизительно в 40–60% образцов МК есть мутации гена, кодирующего протеинкиназу BRAF [8]. Самой частой мутацией в гене BRAF при МК (около 90%) является мутация V600E – замена аминокислоты валин на глутамин, что приводит к увеличению киназной активности фермента BRAF по отношению к нижестоящей киназе MEK во внутриклеточном пути передачи сигнала. Помимо мутации V600E в гене BRAF встречаются и другие мутации (V600K, V600R, V600D, и др.), также активирующие киназную активность этого фермента. Активация MAPK-пути внутриклеточной передачи сигнала через последовательную активацию киназ MEK и ERK вызывает неконтролируемую пролиферацию клетки и блокаду апоптоза [9–10, 19].
Доклинические и клинические данные подтверждают, что эффект препарата, селективно ингибирующего BRAF, направлен на опухоли, которые содержат мутацию в гене BRAF (см. рисунок). Воздействие этих молекул на опухолевые клетки с нормальным BRAF, напротив, может сопровождаться патологической активацией каскада BRAF-MEK-ERK и провоц...












