Акушерство и Гинекология №3 / 2014
Молекулярно-генетические маркеры как прогностические факторы овариального ответа в программах ВРТ
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Генетическая изменчивость представляется важным фактором, детерминирующим овариальный ответ на стимуляцию суперовуляции в программе ЭКО. Расшифровка генетических механизмов регуляции репродуктивной системы способствует созданию персонализированного подхода к лечению бесплодия в репродуктивной медицине. Исследования по изучению генных ассоциаций выявили ряд полиморфизмов генов (single-nucleotide polymorphism – SNP), влияющих на синтез и активность гормонов, факторов роста и др. и таким образом участвующих в овариальном ответе. Этим можно объяснить встречающуюся индивидуальную вариабельность в ответе яичников на стимуляцию их функции. Генетические полиморфизмы могут стать важнейшими предиктивными факторами овариального ответа. Роль полиморфизмов таких генов, как FSHR, ESR1, ESR2, LHB, LHCGR, AMH, AMHR2, BMP15 и др. в прогнозировании овариального ответа в программах ЭКО представляет значительный интерес. В настоящем обзоре проведен систематический анализ данных, имеющихся в современной литературе, по выявлению молекулярно-генетических факторов, оказывающих влияние на ответ яичников в программах вспомогательных репродуктивных технологий.
Распространенность бесплодия среди супружеских пар репродуктивного возраста растет, достигая 15%. С развитием экстракорпорального оплодотворения (ЭКО) многие проблемы, связанные с бесплодием, были успешно преодолены. Неудивительно, что в 2010 г. Нобелевская премия в области физиологии и медицины была присуждена профессору R.G. Edwards за технологию искусственного оплодотворения in vitro, прорыв, который помог миллионам бесплодных пар во всем мире зачать и родить детей [1]. Сегодня, по оценкам экспертов, 2–3% всех родов в развитых странах являются результатом программ ЭКО [2].
Современные подходы к диагностике и лечению бесплодных супружеских пар основаны на достижениях фундаментальных наук в области изучения молекулярно-генетических механизмов, лежащих в основе реализации процесса репродукции у человека. Расшифровка генетических механизмов регуляции репродуктивной системы способствует созданию персонализированного подхода к лечению бесплодия в репродуктивной медицине.
Были предложены различные предикторы исходов стимуляции функции яичников, такие как возраст, овариальный резерв (объем яичников и число антральных фолликулов), гормональный статус, курение и др. [3–5].
Кроме того, генетическая изменчивость также представляется важным фактором, детерминирующим овариальный ответ на стимуляцию суперовуляции в программе ЭКО [6]. Клинико-ассоциативные исследования по изучению генных объединений выявили ряд полиморфизмов генов (single nucleotide polymorphisms, SNP), участвующих в овариальном ответе, затрагивающих гонадотропин, стероидные гормоны и др. Большинство из них оказывает эффект на уровне мРНК или последовательности связывания белков. Этим можно объяснить встречающуюся индивидуальную вариабельность в ответе яичников на стимуляцию их функции [7].
Влияние полиморфизмов генов на исходы стимуляции суперовуляции в программе ЭКО анализировалось не одной группой исследователей, но фармакогенетический подход к дозированию экзогенного ФСГ по-прежнему до конца не разработан [6].
Современное представление о взаимодействие генов, вовлеченных в регуляцию овариального ответа, представлено на рисунке.
Полиморфизм гена рецептора ФСГ (FSHR)
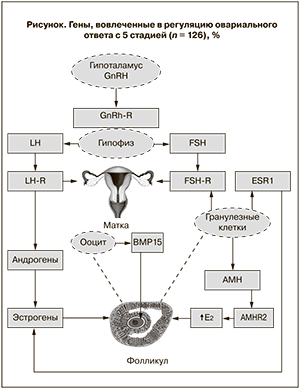 К настоящему времени ген рецептора ФСГ является первым и наиболее изученным генетическим фактором, имеющим значение при стимуляции суперовуляции. Хорошо известно, что физиологическое действие ФСГ зависит от активации его рецептора (FSHR), который экспрессируется гранулезными клетками. Поскольку успех стимуляции функции яичников в значительной степени зависит от эффективности вводимой пациентке дозы ФСГ, то основным геном, который может «объяснить» различные исходы стимуляции суперовуляции, является ген рецептора ФСГ [6].
К настоящему времени ген рецептора ФСГ является первым и наиболее изученным генетическим фактором, имеющим значение при стимуляции суперовуляции. Хорошо известно, что физиологическое действие ФСГ зависит от активации его рецептора (FSHR), который экспрессируется гранулезными клетками. Поскольку успех стимуляции функции яичников в значительной степени зависит от эффективности вводимой пациентке дозы ФСГ, то основным геном, который может «объяснить» различные исходы стимуляции суперовуляции, является ген рецептора ФСГ [6].
Ген FSHR локализуется на участке хромосомы 2p21 и состоит из 10 экзонов. В нем идентифицировано более 148800 SNPs, из которых наиболее изучены rs6165 и rs6166. Оба полиморфизма локализованы в экзоне 10, rs6165 приводит к аминокислотной замене Thr307Ala во внеклеточном домене белка (гормон-связывающей области), а rs6166 – к аминокислотной замене Asn680Ser во внутриклеточном домене [6]. Имеется большое количество данных, подтверждающих, что генетическая изменчивость рецептора ФСГ влияет на результаты стимуляции суперовуляции [8–10].
Аллель 680Ser FSHR ассоциирован с повышенным базальным уровнем ФСГ (ключевого маркера овариального резерва и наиболее изученного возможного предиктора овариального ответа на стимуляцию суперовуляции) и необходимостью введения высоких доз гонадотропинов при стимуляции функции яичников [7, 10].
При этом в исследовании, проведенном Boudjenah и соавт. (2012), показано, что женщины, гомозиготные по аллелю 680Ser, имели большее число зрелых ооцитов, чем гомозиготные по аллелю 680Asn...












