Акушерство и Гинекология №3 / 2015
Молекулярно-генетические предикторы овариального ответа, качества ооцитов и эмбрионов в программах вспомогательных репродуктивных технологий
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Цель исследования. Поиск молекулярно-генетических маркеров, позволяющих прогнозировать овариальный ответ при стимуляции суперовуляции, характер оогенеза, эмбриогенеза в программах вспомогательных репродуктивных технологий (ВРТ).
Материал и методы. В ходе проспективного исследования случай-контроль обследованы 160 пациенток, обратившихся для проведения программы ЭКО: 80 пациенток с нормальным ответом на стимуляцию яичников, 40 пациенток с «бедным» овариальным ответом, 40 пациенток с «гипер» ответом яичников. Полиморфизм генов FSHR, LHCGR, VEGFA, AMHR2, ESR1 определялся методом полимеразной цепной реакции с анализом кривых плавления.
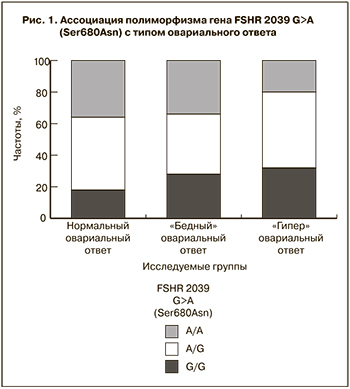
Результаты. Носительство генотипа G/G полиморфизма гена FSHR 2039 G>A (Ser680Asn) предрасполагает к «гипер» ответу яичников (ОШ=3,49 (95% ДИ=1,3-11,6), р=0,021). Наличие генотипа G/G полиморфизма гена LHCGR 935 A>G (Asn312Ser), генотипа С/С полиморфизма гена VEGFA -634 G>C повышает риск получения только незрелых ооцитов (ОШ=3,41(95% ДИ=1,05-11,1), р=0,039 и
ОШ=4,09 (95% ДИ=1,3-11,71), р=0,040 соответственно)). При сочетании этих двух неблагоприятных генотипов вероятность получения зрелых ооцитов составила 62,5%, тогда как для остальных сочетаний генотипов данная вероятность составила 93,4% (ОШ=0,12 (95% ДИ=0,03–0,52), р=0,019). Носительство генотипа А/А полиморфизма гена AMHR2 -482 A>G более чем в 2 раза повышает риск получения незрелых ооцитов (ОШ=2,23(95% ДИ=1,1-4,3), р=0,025). Согласно аутосомно-доминантной модели носительство аллеля G полиморфизма гена ESR1 –351 A>G [XBaI] более, чем в 2 раза повышает риск получения эмбрионов класса С (низкого качества) (ОШ=2,3 (95% ДИ=1,1-4,6), р=0,022).
Заключение. Полиморфизм генов FSHR 2039G>A (Ser680Asn), LHCGR 935A>G (Asn312Ser), VEGFA -634G>C, AMHR2 -482 A>G, ESR1 –351A>G [XBaI] является независимым фактором, способным прогнозировать исход стимуляции суперовуляции, качество ооцитов и эмбрионов в программах ВРТ, и может дополнить арсенал уже имеющихся маркеров
Как известно, более 80 млн супружеских пар по всему миру страдают бесплодием и прибегают к лечению методом экстракорпорального оплодотворения (ЭКО), важным этапом которого является стимуляция суперовуляции. Овариальный ответ широко варьирует у различных пациенток [1].
Возможность более точно прогнозировать особенности ответа яичников на стимуляцию суперовуляции представляет значительный интерес, как клинический, так и научный.
Существуют различные предикторы исходов стимуляции функции яичников: возраст, овариальный резерв, гормональный статус, неблагоприятные экзогенные факторы и другие [2]. Однако эти маркеры не обладают достаточной прогностической способностью [3, 4], в связи с чем поиск оптимальных прогностических факторов не прекращается и в настоящее время. Особое внимание уделяется генетической изменчивости. Показана ассоциация овариального ответа с полиморфизмами более 10 генов, однако до сих пор генотипирование не включено в систему прогнозирования индивидуального характера овариального ответа. Разработка критериев прогнозирования овариального ответа в программах вспомогательных репродуктивных технологий (ВРТ) путем определения индивидуализированных генетических маркеров является современной актуальной и перспективной проблемой.
Целью данного исследования стал поиск генетических маркеров, позволяющих прогнозировать ответ яичников на стимуляцию суперовуляции, характер оогенеза, эмбриогенеза в программах ВРТ.
Материал и методы исследования
 Проведено проспективное исследование случай-контроль на базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Исследовались 10 полиморфных локусов генов, кодирующих: антимюллеровый гормон AMH 146 G>T (Ile49Ser) [rs 10407022]; его рецептор AMHR2 (-482 A>G) [rs 2002555]; эстрогеновый рецептор ESR1 –397 T>C [PvuII] [rs2234693]; ESR1–351 A>G [XBaI] [rs 9340799]; ESR2 G>A [RsaI] [rs 4986938]; рецептор ФСГ FSHR2039 G>A (Ser680Asn) [rs 6166]; рецептор ЛГ/ХГ LHCGR 935 A>G (Asn312Ser) [rs 2293275]; LHCGR 872 A>G (Asn291Ser) [rs 12470652]; сосудисто-эндотелиальный фактор роста VEGFA-634 G>C [rs 2010963]; ингибитор активатора плазминогена SERPINE1 (PAI-1) -675(5G>4G) [rs 1799889]. Генотипирование производилось методом полимеразной цепной реакции с анализом кривых плавления модифицированным методом «примыкающих проб». ДНК для генотипирования выделяли из образцов периферической крови, взятой с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов. Определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Проведено проспективное исследование случай-контроль на базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Исследовались 10 полиморфных локусов генов, кодирующих: антимюллеровый гормон AMH 146 G>T (Ile49Ser) [rs 10407022]; его рецептор AMHR2 (-482 A>G) [rs 2002555]; эстрогеновый рецептор ESR1 –397 T>C [PvuII] [rs2234693]; ESR1–351 A>G [XBaI] [rs 9340799]; ESR2 G>A [RsaI] [rs 4986938]; рецептор ФСГ FSHR2039 G>A (Ser680Asn) [rs 6166]; рецептор ЛГ/ХГ LHCGR 935 A>G (Asn312Ser) [rs 2293275]; LHCGR 872 A>G (Asn291Ser) [rs 12470652]; сосудисто-эндотелиальный фактор роста VEGFA-634 G>C [rs 2010963]; ингибитор активатора плазминогена SERPINE1 (PAI-1) -675(5G>4G) [rs 1799889]. Генотипирование производилось методом полимеразной цепной реакции с анализом кривых плавления модифицированным методом «примыкающих проб». ДНК для генотипирования выделяли из образцов периферической крови, взятой с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов. Определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
В исследование включены 160 пациенток, соответствовавших критериям включения (возраст 18–36 лет, женское бесплодие трубного происхождения, мужской фактор бесплодия при отсутствии тяжелой патозооспермии, регулярный менстру...












