Клиническая Нефрология №1 / 2024
Нефрогенная анемия у пациентов, получающих заместительную почечную терапию, патогенез и резистентность
1) Кафедра нефрологии и диализа ФПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова», Санкт-Петербург, Россия;
2) Городской нефрологический центр Санкт-Петербургское ГБУЗ «Городская Мариинская больница», Санкт-Петербург, Россия;
3) Кафедра внутренних болезней, клинической фармакологии и нефрологии ФГБОУ «Северо-Западный государственный медицинский университет им. И.И. Мечникова», Санкт-Петербург, Россия
Последовательность вовлечения факторов, принимающих участие в патогенезе нефрогенной анемии (НА), дебютирует с развития нефросклероза, ретенции уремических токсинов и активации воспалительных цитокинов, в качестве вторичных механизмов развития НА присоединяются нарушения кислородного сенсора в почках, регуляции эритропоэза, синтеза эндогенного эритропоэтина и развитие его дефицита, развитие функционального дефицита железа и эриптоз. Понимание этих процессов служит основой патогенетической терапии НА препаратами железа и рекомбинантного человеческого эпоэтина (рчЭПО), которая позволяет достичь целевого уровня гемоглобина у 95% пациентов. Преходящая резистентность на фоне осложнений ХБП или интеркуррентных заболеваний может развиваться у значительной части пациентов. Какова роль в лечении резистентной анемии рчЭПО, препаратов железа и ингибиторов пролилгидроксилаз? Консенсус по этому вопросу отсутствует. Знание особенностей резистентности НА позволяет обосновать терапевтическую тактику, минимизируя риски применения эритропоэзстимулирующих препаратов.
Введение
Анемия – одно из самых частых осложнений хронической болезни почек (ХБП). Популяционные исследования показывают однозначный тренд нарастания частоты выявления нефрогенной анемии (НА) с прогрессией ХБП [1–3]. Статистически достоверное возрастание частоты развития анемии при ХБП отмечается при снижении скорости клубочковой фильтрации (СКФ) до 60–70 мл/мин [1]. Появление анемии у пациентов на начальных стадиях ХБП в основном обусловлено особенностями течения заболевания почек и сопутствующим коморбидным фоном, и причины ее развитие, чаще всего выходят за рамки патогенеза истинной НА. Точно так же следует расценивать развитие у пациентов ХБП 4–5-й ст. анемии, резистентной к терапии стимулирующими эритропоэз агентами.
Лечение НА основано на понимании ее патогенеза. Оно сводится к устранению ведущих патогенетических факторов, начиная с адекватной коррекции уремии, минимизации воспаления, обеспечения достаточных запасов железа, завершаясь назначением стимуляторов эритропоэза. Базисные принципы лечения НА отработаны в течение последних трех десятилетий. Они научно обоснованы, изложены в литературе и национальных практических рекомендациях.
Появление нового направления патогенетической терапии НА связано с воздействием на систему стабилизации гипоксией индуцируемого фактора (ГИФ). Обоснование нового подхода к терапии НА также базируется на патогенезе ее развития, а именно активации синтеза эндогенного эпоэтина (ЭПО) ренальной и экстраренальной природы, обусловленной снижением доставки кислорода тканям и уменьшения функционального блока доставки железа в ядерные клетки эритропоэза, необходимого для синтеза гемоглобина (Hb). Применение ингибиторов пролилгидроксилаз в качестве альтернативы препаратам рекомбинантного человеческого ЭПО (рчЭПО) позволяет воздействовать на оба направления патогенетической терапии НА. При использовании ингибиторов пролилгидроксилаз для лечения НА на первый план выступают вопросы доказательства их эффективности и безо-пасности, отмены применяемых стимуляторов эритропоэза, а также подтверждения преимущества их использования у определенной категории пациентов. Несмотря на большой объем клинических исследований, обзоров и мета-анализов, относящихся к препаратам группы ингибиторов пролилгидроксилаз, по всем этим вопросам консенсус не достигнут.
Цель настоящей работы – представить обзор причин развития резистентности к стимулирующим эритропоэз препаратам при НА с учетом ее патогенеза, что поможет клиницисту обосновать подходы к лечению.
Патогенез НА
НА относится к гипорегенеративным анемиям, обусловленным неэффективным эритропоэзом. Причины ее развития – это факторы, связанные с ХБП, которые приводят к нарушению функционирования эритрона, начиная с родоначальных, пролиферирующих и созревающих клеток и заканчивая зрелыми эритроцитами, циркулирующими в крови.
Последовательность вовлечения различных факторов, принимающих участие в патогенезе НА, дебютирует с развития нефросклероза, ретенции уремических токсинов и активации воспалительных цитокинов (см. рисунок). Дальнейшие механизмы развития НА следует рассматривать как вторичные. К ним можно отнести модификацию механизмов регуляции эритропоэза, присущих здоровым лицам на уровне генома, дефицит синтеза эндогенного ЭПО, развитие функционального дефицита железа, активацию апоптоза и программированной клеточной смерти.
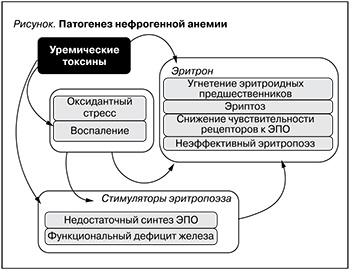
Уремические токсины
С целью систематизации представлений о роли уремических токсинов в развитии НА следует выделить их непосредственное влияние на кроветворную систему, воспаление, оксидативный стресс и эриптоз.
По сравнению с клетками других органов и систем для эритрона описано гораздо меньше токсинов, обладающих прямым действием. Было показано, что накопление в клетках эритропоэза АДМА ассоциируется с повышением резистентности к ЭПО, что авторы связывают со снижением продукции оксида азота, стимулирующего эритропоэз [4]. Такие полиамины, как спермин, спермидин, путресцин и кадаверин («трупные яды»), снижают пролиферацию и созревание ядерных эритроидных предшественников независимо от величины ЭПО [5]. Блокирующий эффект на ядерные эритроидные клетки можно ожидать от β-2 микроглобулина, моноцитарного колонии стимулирующего фактора, токсинов, связанных с белками (например, хинолиновая кислота) и токсинов средней молекулярной массы [6]. Особое место среди уремических токсинов занимает индоксилсульфат. Его роль в развитии НА прослеживается на многих критических для эритропоэза этапах [7]. Он ингибирует пути активации рецептора ЭПО, подавляет продукцию HIF, блокирует транскрипции гена ЭПО при гипоксии, а также снижает темп эритроидой продукции посредством активации Са2+-зависимого НАДФ оксидазного и глутатионового механизмов [5].
Количество продуктов ретенции при уремии, потенциально оказывающих прямое и косвенное влияние на эритрон, вероятно, гораздо больше. Включе...












