Кардиология №6 / 2015
Неинвазивные электрофизиологические предикторы и биомаркеры угрожающих жизни аритмий у больных ишемической болезнью сердца: данные 2-летнего проспективного наблюдения
ФГБУ Научный центр сердечно-сосудистой хирургии им. А. Н. Бакулева, Москва
Внезапная сердечная смерть (ВСС) — одна из самых частых причин кардиальной летальности. В США ВСС уносит ежегодно около 325 000—350 000 жизней [1], что составляет 50—100 случаев на 100 000 населения [2]. В России ежегодная частота внезапных смертей составляет приблизительно 200 000—250 000 случаев [3]. Эта цифра несколько ниже мировых данных. Но, учитывая имеющиеся в нашей стране трудности в оказании экстренной помощи, обусловленные в первую очередь большими расстояниями и низкой плотностью населения в большинстве российских регионов, можно предполагать, что реальная частота ВСС, включая незарегистрированные случаи, значительно превышает данные американских и европейских регистров. Как известно, наиболее частой причиной ВСС служат желудочковые тахиаритмии, развившиеся на фоне ишемической болезни сердца (ИБС), и особенно часто – острого коронарного синдрома, в том числе как первого проявления заболевания. Интересны результаты статистического исследования заболеваний сердца и инсультов («Heart Disease and Stroke Statics — a 2013 update»), по данным которого, Россия лидирует по уровню смертности от коронарного атеросклероза среди других стран мира, в несколько раз опережая европейские страны и США [4]. Несмотря на огромный прогресс в оказании неотложной помощи за последние десятилетия, выживаемость после эпизодов злокачественных аритмий даже в экономически развитых странах не превышает 5% [5].
В настоящее время наиболее эффективным способом профилактики ВСС является имплантация кардиовертера-дефибриллятора (КВД) пациентам из группы высокого риска. Приборы, изобретенные в 1969 г. и впервые имплантированные человеку в 1980 г., в настоящее время широко и успешно применяются для первичной и вторичной профилактики ВСС [6]. Однако антиаритмические устройства способны помочь лишь небольшому числу больных, у которых высокий риск ВСС может быть определен до первого эпизода угрожающей жизни аритмии [2].
Накоплено немало данных о самых разных потенциальных предикторах ВСС, в том числе неинвазивных показателях электрической нестабильности миокарда; биохимических маркерах воспаления, повреждения, перегрузки миокарда; параметрах современных методов визуализации [7]. Однако на практике для отбора пациентов на имплантацию КВД с целью первичной профилактики ВСС используется лишь несколько показателей. Согласно действующим национальным (ВНОА, 2013) и международным рекомендациям (ACCF/AHA/HRS, 2012), это — перенесенный инфаркт миокарда — ИМ (не менее 40 дней назад); фракция выброса (ФВ) левого желудочка (ЛЖ) ≤35%; сердечная недостаточность II—III функционального класса (ФК) по классификации NYHA (или ФВ ЛЖ ≤30% и I ФК по классификации NYHA) (класс I, уровень доказанности А) [1, 8].
Небольшое число предикторов определяет относительно широкий круг больных, нуждающихся в антиаритмическом устройстве. При этом клинико-терапевтические показания ограничены финансово-экономическими сложностями. Несмотря на то что имплантация КВД снижает смертность у больных с низкой ФВ ЛЖ [9, 10], при долгосрочном наблюдении за этими пациентами выявлены ограничения современного подхода к отбору кандидатов на имплантацию КВД [11]. В связи с перечисленными сложностями проблема стратификации риска ВСС остается нерешенной. Отсутствие данных о первичной профилактике среди российских исследований говорит само за себя. Так, согласно данным ведущей российской аритмологической клиники — Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева РАМН, все 165 аппаратов КВД, имплантированные 117 пациентам с 1993 г. по 2004 г., были направлены на вторичную профилактику ВСС [6]. С 2005 г. по 2008 г. этими же авторами с целью первичной профилактики были выполнены 22 имплантации [12]. Совершенно очевидна необходимость новых предикторов ВСС, позволяющих изменить подход к первичной профилактике и сделать ее более доступной. Первоочередной задачей являются совершенствование и оптимизация неинвазивных методов стратификации факторов риска.
Материал и методы
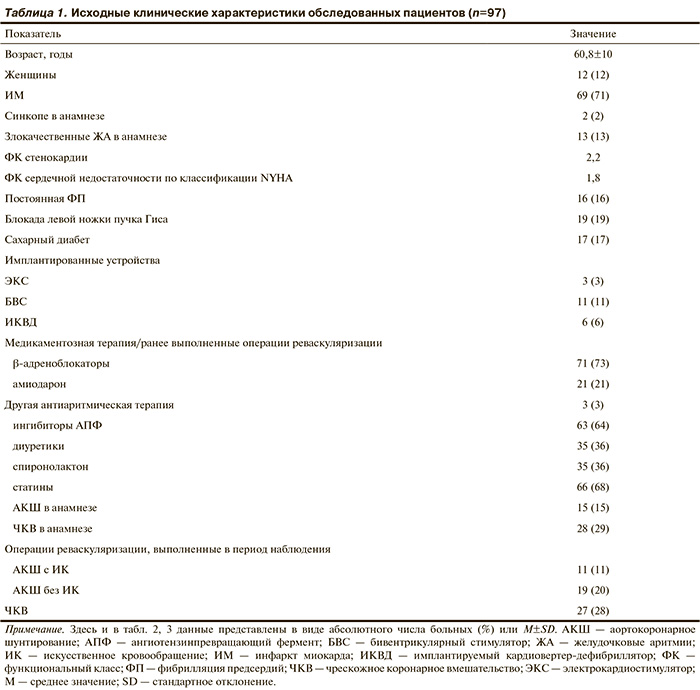
Характеристики пациентов. Обследованы 108 пациентов с ИБС в возрасте от 38 до 81 года, находившихся на стационарном лечении и амбулаторном обследовании в отделении неинвазивной аритмологии и хирургического лечения комбинированной патологии или отделении малоинвазивного хирургического лечения ИБС НЦ ССХ им. А.Н. Бакулева РАМН в период с марта 2009 г. по апрель 2011 г. Диагноз верифицирован на основании данных коронарографии. Средний период наблюдения составил 25±11 мес. Все пациенты дали информированное согласие на участие в исследовании. После выписки из стационара длительно наблюдались 97 пациентов, которые и составили основную исследуемую группу. По причине потери регулярного контакта с клиникой из исследования выбыли 11 человек, дальнейшая судьба их неизвестна. У 61% пациентов диагностирована сердечная недостаточность II—III ФК по NYHA, признаки сердечной недостаточно...












