Фарматека №18 (251) / 2012
Некоторые подходы к созданию фармакологически активных полимерных производных лекарственных препаратов, обладающих противоопухолевой активностью
1 Нижегородская ГМА, Нижний Новгород; 2 Нижегородский ГУ, Нижний Новгород
В статье отражены основные проблемы, связанные с противоопухолевой химиотерапией, используемой в настоящее время. Представлены основные группы используемых цитотоксических средств и особенности их механизма действия. Изложены общие представления о перспективном современном методе противоопухолевой терапии – применении полимерных производных лекарственных препаратов. Полимерные соединения способны изменять фармакокинетику лекарственных средств, увеличивать время их циркулирования в крови благодаря высоким значениям молекулярной массы. Это позволяет повысить эффективность процесса захвата полимерных производных опухолевыми клетками, которые в отличие от нормальных характеризуются усиленным эндоцитозом. Обсуждаются характеристики полимеров (поликатионов, полианионов и нейтральных полимеров), используемых для транспортных систем селективной доставки лекарственных препаратов. Определены особенности разработки мицеллярных систем доставки и систем прививочного типа, представленных классической моделью Рингсдорфа.
Успешное лечение онкологических заболеваний – одна из наиболее острых и актуальных медико-социальных проблем. Так, в 2010 г. в РФ выявлено 516 874 случая злокачественных новообразований, а
показатель заболеваемости на 100 тыс. населения России составил 364,2, что на 2,4 % выше уровня 2009 г. и на 17,8 % выше уровня 2000 г. [1].
В настоящее время приоритетными задачами фундаментальной и клинической медицины являются поиск и разработка новых подходов и усовершенствование традиционных способов терапии для увеличения эффективности лечения злокачественных новообразований. Методы борьбы с онкологическими заболеваниями на сегодняшний день основаны на трех основных способах лечения – хирургическом вмешательстве, радио- и химиотерапии (ХТ). Последняя занимает одно из центральных мест в лечении опухолевых заболеваний. В настоящее время выделяют следующие виды ХТ: адъювантную, неоадъювантную, индукционную и лечебную. Адъювантная (“дополнительная”) ХТ направлена на скрытые метастазы, которые могут иметь место, и проводится сразу после хирургического вмешательства во избежание рецидива. Неоадъювантная ХТ — аналог адъювантной, но осуществляется перед оперативным лечением, позволяя уменьшать опухоль до размеров, когда можно выполнять органосохраняющую операцию и выяснять чувствительность опухоли к ХТ. Индукционная ХТ назначается при неоперабельном процессе с целью приведения его к операбельному состоянию. Лечебная ХТ проводится при наличии опухолевого очага [2, 3].
Классификации противоопухолевых средств (ПОС) носят условный характер, поскольку многие препараты, объединенные в одну группу, имеют уникальные механизмы действия и эффективны в отношении совершенно разных нозологических форм злокачественных новообразований (более
того, многие авторы относят одни и те же препараты к разным группам). Тем не менее эти классификации представляют определенный практический интерес – минимум в качестве упорядоченного перечня препаратов. Так, согласно анатомо-терапевтическохимической (АТХ) классификации лекарственных средств [4], выделяют следующие группы ПОС: алкилирующие агенты, антиметаболиты, противоопухолевые антибиотитики, алкалоиды растительного происхождения и
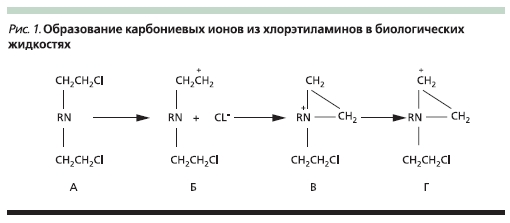
проч. К алкилирующим агентам относятся сарколизин, циклофосфамид, хлорамбуцил, новоэмбихин. Действие алкилирующих агентов, схематично представленное на рис. 1 на примере хлорэтиламинов (А), основано на том, что в растворах и биологических жидкостях они отщепляют ионы хлора с
образованием электрофильного карбониевого иона (Б), который переходит в этиленимоний (В). Последний также образует функционально активный карбониевый ион (Г), взаимодействующий с нуклеофильными структурами ДНК (гуанин, фосфатные группы и др.) [5].
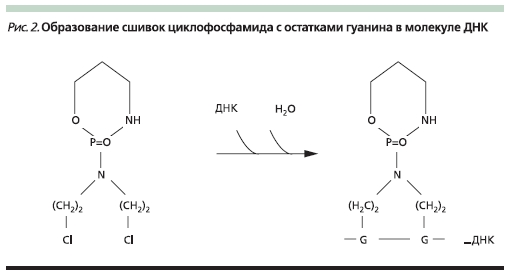
Взаимодействие алкилирующих веществ с ДНК (рис. 2), в т. ч. поперечное связывание молекул ДНК, нарушает ее стабильность, вязкость и впоследствии целостность. Все это приводит к резкому угнетению жизнедеятельности клеток, их способность к делению подавляется, и многие из них гибнут.
Алкилирующие вещества действуют на клетки в интерфазе. Особенно выражено их цитостатическое действие в отношении быстропролиферирующих клеток.
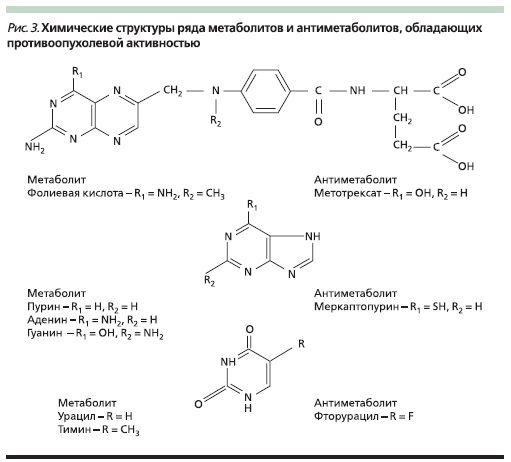
Антиметаболиты, являясь антагонистами естественных метаболитов (рис. 3), вмешиваются в синтез ДНК и РНК, что также приводит к угнетению деления клеток и их гибели. Действие проявляется на разных этапах синтеза нуклеиновых кислот и зависит от того, антагонистом какого метаболита является данный препарат. Например, метотрексат – антагонист фолиевой кислоты, нарушает образование пуринов и тимидина. Меркаптопурин и тиогуанин угнетают включение пуринов в полинуклеотиды; фторурацил, тегафур и цитарабин являются антагонистами пиримидина, нарушают синтез нуклеотидов и их включение в ДНК [6].
Антибиотики антрациклинового ряда, к которым относятся доксорубицин, даунорубицин, идарубицин,
митоксантрон, оказывают многоплановое действ...












