Терапия №6 / 2018
Некоторые показатели системы матриксных металлопротеиназ при дисплазии соединительной ткани
1 ФГБОУ ВО «Ставропольский государственный медицинский университет», кафедра госпитальной терапии;
2 ГБУЗ СК «Ставропольская краевая клиническая больница»
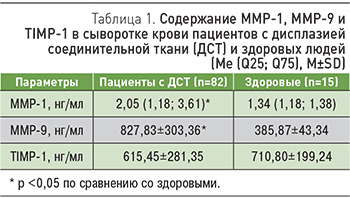
Цель исследования. Оценить показатели системы матриксных металлопротеиназ (MMР-1, ММР-9, TIMP-1) у пациентов с дисплазией соединительной ткани (ДСТ). Материал и методы. Обследованы 82 пациента (64 мужчины и 18 женщин, средний возраст 21,96±4,47 года) с ДСТ. Критериями включения в исследование являлись ДСТ у пациентов обоего пола в возрасте 18–35 лет, подписавших информированное согласие на участие в исследовании. Исследованы показатели ММР-1 и -9, TIMP-1 в сыворотке крови у пациентов с ДСТ. Диспластические синдромы и фенотипы были представлены первичным миксоматозным (n=14) и семейным пролапсом митрального клапана (n=14), спорадическим синдромом пролапса митрального клапана (n=49), неклассифицируемым фенотипом (n=1), повышенной диспластической стигматизацией (n=4). Для оценки баланса между ММР и их ингибитором были изучены коэффициенты ММР-1/TIMP-1 и ММР-9/TIMP-1. Результаты. Установлено повышение ММР-1, ММР-9, коэффициентов ММР-1/TIMP-1 и ММР-9/TIMP-1 при ДСТ. Более выраженные отклонения в системе ММР зарегистрированы в группах с костно-суставными диспластическими проявлениями, а также при миксоматозной дегенерации пролабирующего митрального клапана и гемодинамически значимой митральной регургитации. Заключение. Сывороточные показатели MMP-1 и -9, а также их дисбаланс с TIMP-1 могут быть использованы как лабораторные тесты для оценки ремоделирования соединительнотканных структур при ДСТ.
Изучение матриксных металлопротеиназ (ММР) и их тканевых ингибиторов (TIMP) показало свою актуальность при оценке механизмов развития многих заболеваний. Так, доказана роль ММР в патогенезе сердечно-сосудистых (атеросклероз, инфаркт миокарда, рестеноз, кардиомиопатии, хроническая сердечная недостаточность, инсульт, аневризма аорты), иммунных (ревматоидный артрит, системная красная волчанка, гломерулонефрит, рассеянный склероз), вирусных болезней, семейного остеолиза и др. [1, 2].
MMP принадлежит центральная роль практически во всех физиологических и патологических катаболических процессах экстрацеллюлярного матрикса соединительной ткани [3]. Нарушение баланса между деградацией и синтезом компонентов внеклеточного матрикса вполне очевидно в случаях наследственной, или врожденной, дисплазии соединительной ткани (ДСТ), под которой понимают генетически детерминированные дефекты волокнистых структур и основного вещества, приводящие к нарушению формообразования органов, систем и имеющие прогредиентное течение [4].
Известно, что активность ММР регулируется в том числе взаимодействиями со специфическими ингибиторами – TIMP [3]. Есть основания полагать, что нарушение соотношения ММР/TIMP может быть включено в механизмы возникновения и прогрессирования диспластикозависимых осложнений. Так, имеются сведения об изменении активности ММР при дефиците или нарушении структуры фибриллина-1, который, как известно, стабилизирует ММР. Подобные нарушения отмечены у больных синдромом Марфана и пациентов с двустворчатым аортальным клапаном [5]. В экспериментальных исследованиях продемонстрирована роль ММР-2 в формировании миксоматозного пролапса митрального клапана (ПМК) и различных скелетных аномалий [6]. У пациентов с мезенхимальной дисплазией сердца выявлены увеличенные показатели сывороточной концентрации ММР-9 и отношения ММР-9/TIMP-1 [3].
Между тем понимание механизмов развития ДСТ имеет первостепенное значение для своевременного выявления изменений, которые в дальнейшем обусловливают ассоциированные с соединительнотканными нарушениями осложнения – прогрессирование костно-мышечных дисплазий, кардиального ремоделирования, аритмического синдрома, развитие артериальной гипертензии и т.д.
Цель исследования – оценить показатели системы матриксных металлопротеиназ (MMР-1, ММР-9, TIMP-1) у пациентов с ДСТ.
 МАТЕРИАЛ И МЕТОДЫ
МАТЕРИАЛ И МЕТОДЫ
Обследованы 82 пациента (64 мужчины и 18 женщин, средний возраст 21,96±4,47 года) с ДСТ. Критериями включения в исследование являлись: ДСТ у пациентов обоего пола в возрасте 18–35 лет, подписавших информированное согласие на участие в исследовании. Критерии исключения:
- моногенные наследственные синдромы (Марфана, Элерса–Данло и др.);
- хронические соматические заболевания, в том числе сердечно-сосудистые (артериальная гипертензия, ишемическая болезнь сердца, некоронарогенные заболевания миокарда, пороки сердца и др.);
- острые или обострения хронических воспалительных и/или инфекционных заболеваний в течение последних 3 мес;
- оперативное вмешательство в течение последних 2 мес;
- злокачественные заболевания; беременность и послеродовой период.
Выбор критериев исключения был обусловлен необходимостью устранения заболеваний и состояний, которые могут быть причиной изменения в системе ММР.
ДСТ устанавливали в соответствии с критериями Российских рекомендаций [4, 7]. Фенотип пациентов включал астенический тип конституции (51,22% наблюдений), долихостеномелию (30,49%), арахнодактилию (21,95%), воронкообразную деформацию г...












