Клиническая Нефрология №1 / 2022
Незаменимые аминокислоты и их α-кето- и гидроксианалоги в диете больных уремией (биохимический аспект)
Биофизприбор, СКТБ, филиал ФГУП ЭПМ ФМБА России, Санкт-Петербург, Россия
При уремии возникает необходимость снижения уровня азота в питании при сохранении удовлетворения потребности человеческого организма в незаменимых аминокислотах. Для этого последние заменяют в диете соответствующими α-кетокислотами или находящимися с ними в равновесии α-гидроксикислотами в расчете на то, что при переаминировании кетокислоты превратятся в аминокислоты. Однако некоторые незаменимые аминокислоты не заменяют соответствующими α-кето- и гидроксикислотами и вводят в неизменном виде. В статье рассматривается возможность замещения α-кето- и гидроксианалогами в диете больных уремией 10 незаменимых аминокислот, из которых 2 заменимы для здоровых людей. Анализируется основание замещения каждой аминокислоты ее аналогом. Даются рекомендации по обеспечению больных треонином и метионином. Поскольку нефропатии могут иметь диабетическое происхождение, каждая аминокислота анализируется также на глюкогенное либо кетогенное действие. Наличие последнего признается основанием для ограничения введения данной аминокислоты и ее α- кето- или гидроксианалога.
Введение
При уремии возникает необходимость резкого снижения содержания азота в питании при сохранении удовлетворения потребности человеческого организма в незаменимых аминокислотах. Для этого последние заменяют в диете соответствующими α-кетокислотами или находящимися с ними в равновесии α-гидроксикислотами в расчете на то, что при переаминировании кетокислоты превратятся в аминокислоты: α-кетоаналоги лейцина, изолейцина, валина, фенилаланина (рис. 1) и α-гидроксианалог метионина. В то же время такие незаменимые аминокислоты, как лизин, треонин, триптофан, а также становящиеся при уремии незаменимыми (условно незаменимыми) гистидин и тирозин вводят в организм в виде аминокислот [1].
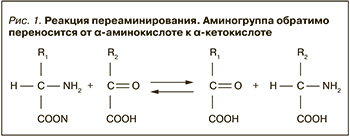
В своей монографии в 1969 г. Т.Т. Березов писал: считается доказанным, что в тканях млекопитающих механизм переаминирования – главный путь дезаминирования L-изомеров фенилаланина, тирозина, лейцина, изолейцина, валина, орнитина, цистеиновой и цистеинсульфиновой кислот, β-аланина, γ-аминомасляной кислоты и частично цистеина. Тот же механизм должен быть отнесен к дезаминированию L-триптофана, которому предшествует разрыв индольного ядра с образованием кинуренина и далее 3-оксикинуренина, которые или подвергаются прямому переаминированию с α-кетоглутаровой кислотой, или распадаются под действием специфической кинурениназы с образованием аланина. Дезаминирование аланина также происходит путем переаминирования. Имеются данные о преимущественной роли переаминирования в дезаминировании аланина, аспарагиновой кислоты, метионина, треонина, серина и др. в печени и почках [2]. При этом Т.Т. Березов не называет лизин, следовательно, он имеет в виду непсредственно аминокислоты, а не продукты их превращения, потому что продукт превращения лизина – α-аминоадипиновая кислота – активно подвергается переаминированию [3]. Т.Т. Березов также отмечает, что переаминирование может происходить в тканях между разнообразными монокарбоновыми донорами и акцепторами аминогрупп без участия дикарбоновых аминокислот [2]. К реакциям этого типа относятся процессы переаминирования между рядом аминокислот и пировиноградной кислотой с образованием аланина и соответствующих α-кетокислот, протекающие в митохондриях печени. Показана и обратимость этих реакций (рис. 1), а также различная способность отдельных тканей катализировать описанные превращения.
Млекопитающим, больным уремией и находящимся на низкобелковой диете, скармливали α-кетокислоты – производные незаменимых аминокислот [4]. Последние синтезировались в организме путем переаминирования. Оказалось, что в виде аминокислот необходимо давать только лизин, для которого отсутствует трансаминаза [5]. В то же время степень использования α-кетокислот для синтеза соответствующих аминокислот различается. Валин, лейцин, изолейцин, метионин и фенилаланин быстро синтезировались путем переаминирования, в то время как гистидин (для подавляющего числа млекопитающих он считается незаменимой аминокислотой, а для здоровых взрослых людей – заменимой), треонин и триптофан синтезировались в меньшей степени, а синтеза лизина вообще не наблюдалось.
В то же время выше уже говорилось, что в питании людей, больных уремией, некоторые аминокислоты не замещают α-кето- или гидроксианалогами. Однако, чтобы сделать вывод, какие незаменимые аминокислоты могут быть заменены в диете этими аналогами, а какие нет, необходимо рассмотреть изменения превращения каждой незаменимой аминокислоты при уремии. Насколько мне известно, такая работа не проводилась. В частности, треонин не заменяется безазотистыми аналогами, исходя из сложившегося стереотипа, что он, как и лизин, не подвергается переаминированию. Между тем переаминирование треонина показано, как уже отмечалось, у млекопитающих, больных уремией [4] и у здоровых людей [3]. Может ли замещение треонина его безазотистыми аналогами в диете людей, больных уремией, компенсировать потребность в нем, сумеет показать только практическое применение этих аналогов. Во всяком случае ничего не известно об усилении распада треонина при уремии, как это имеет место в отношении циклических аминокислот, кроме фенилаланина.
Вторым вопросом, поднятым в статье, будет необходимость обязательной добавки витамина В12 к гидроксианалогу метионина. Если метионин будет синтезироваться путем переаминирования из своего кетоаналога, в который окислится гидроксианалог, это не значит, что основная доля метионина будет распадаться путем переаминирования: она будет, как и в норме, распадаться путем переметилирования, а чтобы последнее оставалось при уремии обратимым, необходимо дополнительное введение в организм витамина В12, который, став коферментом, катализирует реакцию метилирования гомоцистеина в метионин.
Третий вопрос, поднятый в статье, следующий. Все присутствовавшие в диете α-кето- и гидроксианалоги – безазотистые вещества, а потому соответствуют критерию снижения азот...












