Фарматека №8 (281) / 2014
Новые перспективные препараты для лечения HER2-позитивного рака молочной железы
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
В статье приводятся новые достижения лекарственного лечения HER2-позитивного рака молочной железы? которые являются чрезвычайно важным очередным этапом лекарственной онкологии. В обзоре представлен анализ исследований, посвященных оценке эффективности терапии рака молочной железы. Приведены данные исследований, сравнивавших эффективность, безопасность и фармакокинетические показатели при подкожном и внутривенном введении трастузумаба. Подробно описываются дизайн и методология рандомизированного открытого международного исследования EMILIA, оценивавшего эффективность применения TDM-1 по сравнению с комбинацией лапатиниб + капецитабин.
Рак молочной железы (РМЖ) на настоящий момент рассматривается как гетерогенное заболевание, имеющее различные биологические характеристики и подразделяющееся на пять основных молекулярных подтипов (табл. 1). Каждый подтип требует специфического подхода к выбору лекарственной терапии.
Алгоритм лечения метастатического РМЖ (мРМЖ) с положительными гормональными рецепторами показан на рис. 1.
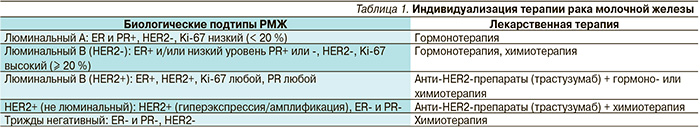
Нелюминальный HER2+ РМЖ лечится анти-HER2-препаратами в сочетании с химиотерапией. В качестве первой линии специфической терапии используется комбинация таксанов и трастузумаба (Герцептин®). Назначение трастузумаба является стандартом и для адъювантной терапии больных HER2+ РМЖ, которая проводится в течение года, при этом длительность адъювантной терапии трастузумабом составляет 1 год.
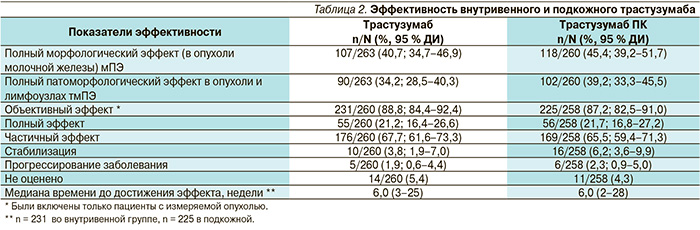
Фактором, в какой-то мере осложняющим длительное лечение трастузумабом в качестве как неоадъювантного, так и адъювантного показания, считается способ его введения, а именно внутривенный. В связи с этим представляются чрезвычайно важными недавно опубликованные данные открытого рандомизированного мультицентрового исследования III фазы HannaH, сравнивавшего трастузумаб для подкожного (трастузумаб ПК) и внутривенного введения в неоадъювантном и затем адъювантном режимах лечения и показавшего равнозначные результаты в отношении эффективности, безопасности и фармакокинетических показателей [1]. С октября 2009 по декабрь 2010 г. в исследование были включены 596 больных из 81 центра. Основные характеристики в группах были хорошо сбалансированы. Химиотерапия включила 4 введения доцетаксела по 75 мг/м2 каждые 3 недели, затем 4 цикла FEC: 5-фторурацил 500 мг/м2, эпирубицин 75 мг/м2 и циклофосфамид 500 мг/м2 каждые 3 недели. Одновременное введение трастузумаба и эпирубицина сочли допустимым для больных ранним РМЖ, опираясь на низкий показатель кардиотоксичности подобной терапии при низких дозах антрациклинов в данной комбинации – доксорубицин 60 или эпирубицин 90 мг/м2 [2–5]. Внутривенно трастузумаб вводили каждые 3 недели в стандартном режиме: первая доза – 8 мг/кг (доза насыщения), затем по 6 мг/кг (поддерживающая доза). Трастузумаб ПК применялся в фиксированной дозе 600 мг (5 мл), введение препарата занимало не более 5 минут. В качестве вспомогательного вещества трастузумаб ПК содержит человеческую рекомбинантную гиалуронидазу, обеспечивающую возможность подкожного введения препарата.
После операции больные продолжали получать трастузумаб до окончания года с момента первого введения; лучевая и гормонотерапия назначались в соответствии с локальными стандартами. К моменту первоначального анализа 116 больных каждой группы закончили лечение, но никто не завершил фазу наблюдения: медиана времени наблюдения составила 12,2 месяца в группе внутривенного введения и 12,4 – в группе подкожного. Медиана интенсивности дозы трастузумаба составила 135,9 мг/нед в группе трастузумаба для внутривенного введения и 195,9 мг/нед – в группе трастузумаба ПК. В фармакокинетический анализ были включены 235 больных группы внутривенного введения и 234 – группы трастузумаба ПК.
При использовании трастузумаба ПК перед хирургическим этапом лечения создавалась концентрация не ниже, чем при внутривенном способе введения. Сравнительные фармакокинетические данные сопоставимы: средняя концентрация перед 8-м циклом (последний цикл перед оперативным вмешательством) составила 57,8 мг/мл (в группе трастузумаба для внутривенного введения) и 78,7 мг/мл (в группе трастузумаба ПК); средняя AUC0-21 дни (мг/мл × день) – 2056 (для внутривенного введения) и 2268 (для подкожного введения). Адъювантное лечение, включившее лучевую и гормонотерапию, оказалось идентичным.
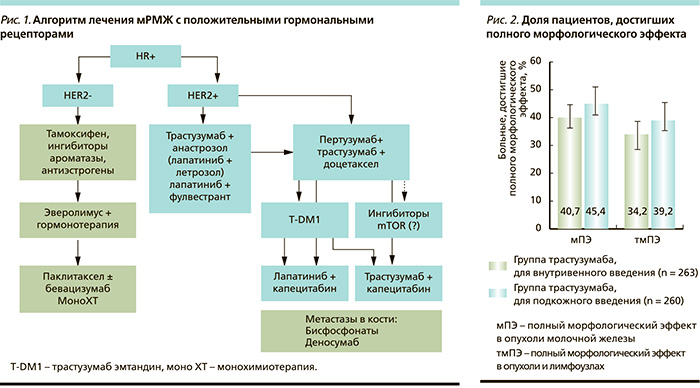
Оценка частоты патоморфологического эффекта представлялась наиболее важной как отражающая прогноз течения заболевания (данные представлены в табл. 2).
Трастузумаб ПК характеризовался сопоставимой эффективностью, полный морфологический эффект (мПЭ) достигнут 118 (45,4 %) из 260 больных группы трастузумаба ПК и 107 (40,7 %) из 263 больных группы внутривенного введения (рис. 2). Схожие результаты получены и при оценке мПЭ с учетом аксиллярных лимфоузлов: в группе подкожного введения – 39,2 %, в группе внутривенного введения – 34,2 %. Другие показатели эффективности, такие как объективный эффект, время до достижения объективного эффекта, также были приблизительно одинаковыми. Зависимости эффекта от веса больных при мультифакторном регрессионном анализе мПЭ отмечено не было.
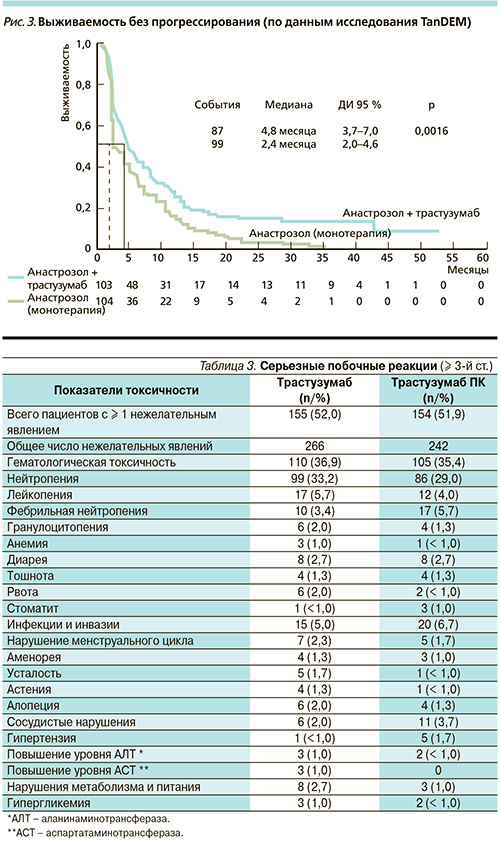
Что касается побочных эффектов, то они также оказались сопоставимыми в обеих группах больных (табл. 3).
Наиболее часто наблюдались алопеция, тошнота, нейтропения, диарея, астения и усталость. В исследовании было зарегистрировано четыре смерти: в группе внутривенного введен...












