Урология №6 / 2019
Новый метод неинвазивного механического разрушения опухолей простаты с помощью импульсного фокусированного ультразвука
1) Физический факультет МГУ им. М. В. Ломоносова, Москва, Россия;
2) Центр промышленного и медицинского ультразвука, Университет шт. Вашингтон, Сиэтл, США;
3) Факультет фундаментальной медицины МГУ им. М. В. Ломоносова, Москва, Россия;
4) Факультет урологии, Университет шт. Вашингтон, Сиэтл, США;
5) Медицинский научно-образовательный центр МГУ им. М. В. Ломоносова, Москва, Россия
Цель исследования: показать принципиальную возможность неинвазивного механического разрушения тканей простаты человека методом гистотрипсии с кипением с помощью высокомощного импульсного фокусированного ультразвука.
Материалы и методы. Сконструирована ультразвуковая установка для получения локализованных механических разрушений в образцах биологической ткани ex vivo под УЗ-контролем. Проведена серия экспериментов по созданию однофокусных малых (с объемом не более 2 мм3) разрушений и одного крупного (более 50 мм3) в образцах ткани простаты ex vivo. Часть образцов (n=2) после облучения была разрезана для визуализации разрушений, другие образцы подвергнуты гистологическому исследованию.
Результаты. При облучении образцов мощными импульсами фокусированного ультразвука под УЗ-контролем в B-режиме в таргетной зоне появлялся участок повышенной эхогенности вследствие генерации парогазовых пузырьков. После воздействия определялись мелкие и крупные участки разрушений в виде полостей, заполненных жидкой суспензией разрушенной ткани. Гистологический анализ подтвердил деструкцию ткани простаты на субклеточные фрагменты в области фокуса.
Заключение. Проведенные пилотные эксперименты показали принципиальную возможность использования метода гистотрипсии с кипением в качестве неинвазивного способа лечения заболеваний простаты.
Введение. Малоинвазивные методы, альтернативные традиционному хирургическому вмешательству, лечения доброкачественной гиперплазии и онкологических заболеваний предстательной железы прочно заняли место в арсенале современного уролога. Тем не менее, специфичность показаний и противопоказаний к использованию данных методов, а также высокая стоимость оборудования и подготовки специалистов существенно ограничивают их клиническое использование. В cвязи с этим минимально инвазивные методы лечения заболеваний простаты, характеризующиеся локальным воздействием на таргетные участки, такие как криохирургия, брахитерапия, дистанционная лучевая терапия, по-прежнему вызывают значительный интерес у клиницистов.
Одним из таких активно развивающихся полностью неинвазивных методов является облучение опухолевых тканей фокусированным ультразвуком высокой интенсивности (HIFU — High Intensity Focused Ultrasound). Механизм действия HIFU состоит в термической абляции, которая применяется для лечения различных доброкачественных и злокачественных опухолей, включая миому матки [1], рак предстательной железы [2], опухоли почек [3], печени [4], заболеваний мозга [5], а также некоторых видов метастатического поражения костей скелета [6].
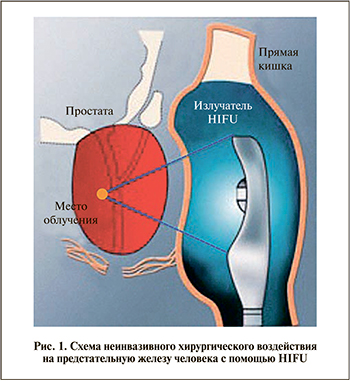 Воздействие на ткани простаты мощным ультразвуковым пучком обычно осуществляется трансректально, с фокусировкой на опухолевом очаге (рис. 1). В фокусе излучателя, где интенсивность ультразвукового поля максимальна, происходит поглощение энергии ультразвука, что вызывает локальный нагрев ткани выше 60ºС и термический коагуляционный некроз. Размеры каждого такого разрушения относительно невелики, порядка размеров рисового зерна, однако путем перемещения фокуса можно разрушить патологический очаг объемом до нескольких кубических сантиметров. Данный хирургический метод уже более 20 лет используется в научно-исследовательских и клинических центрах по всему миру и c его помощью пролечено более 70 тыс. человек [7]. Полученный опыт подробно освещен в медицинской литературе, а также суммирован в ряде содержательных обзоров [2, 8–11].
Воздействие на ткани простаты мощным ультразвуковым пучком обычно осуществляется трансректально, с фокусировкой на опухолевом очаге (рис. 1). В фокусе излучателя, где интенсивность ультразвукового поля максимальна, происходит поглощение энергии ультразвука, что вызывает локальный нагрев ткани выше 60ºС и термический коагуляционный некроз. Размеры каждого такого разрушения относительно невелики, порядка размеров рисового зерна, однако путем перемещения фокуса можно разрушить патологический очаг объемом до нескольких кубических сантиметров. Данный хирургический метод уже более 20 лет используется в научно-исследовательских и клинических центрах по всему миру и c его помощью пролечено более 70 тыс. человек [7]. Полученный опыт подробно освещен в медицинской литературе, а также суммирован в ряде содержательных обзоров [2, 8–11].
Например, в обзоре, основанном на результатах наблюдений за 625 пациентами с локализованным раком простаты, проходивших фокальную терапию с использованием HIFU в ряде ведущих европейских клиник, указаны показатели 5-летней безрецидивной, безметастатической, раковоспецифической и общей выживаемости, составившие 88, 98, 100 и 99 % соответственно [12].
Несмотря на несомненные достоинства метода традиционного трансректального HIFU с термоабляцией, при его клиническом использовании был выявлен ряд недостатков. Во-первых, тепловой режим воздействия приводит к относительно медленному нагреванию заданного объема ткани и сопровождается диффузией тепла вокруг патологического очага, что увеличивает вероятность сопутствующих повреждений мочевого сфинктера и нервно-сосудистых пучков. Это может стать причиной недержания мочи и сексуальной дисфункции [13]. Во-вторых, при тепловом нагреве практически невозможно осуществлять визуальный контроль лечения в режиме реального времени с помощью ультразвука, поскольку участок облучения, нагретый до температуры 60–80ºС, не отличается от окружающих тканей при визуализации в B-режиме.
Таким образом, HIFU-терапия является методом с доказанной клинической эффективностью, при этом обладающим некоторыми недостатками, такими как ограниченность визуального контроля за воздействием в режиме реального времени и недостаточно точный контроль границы получаемого термического разрушения.
В наших предыдущих исследованиях был предложен альтернативный подход, названный гистотрипсией с кипением, основанный на механической дезинтеграции ткани с использованием ультразвука высокой амплитуды, который изучается в рамках грантовых проектов и договоров между Университетом штата Вашингтон в Сиэтле (UW) и Московским государственным университетом (МГУ) в России [14]. При применении традиционного термического HIFU используется непрерывный режим облучения ткани гармоническими волнами относительно невысокой интенсивности (характерная амплитуда давления в фокусе – 2–8 МПа) в течение нескольких секунд. В то же время метод гистотрипсии с кипением реализуется посредством облучения опухоли короткими (до 10 мс) и редкими (время повторения импульсов примерно в 100 раз больше их длительности), но очень мощными импульсами (пиковое давление больше 60 МПа), в профиле которых в таргетной зоне за счет нелинейных эффектов формируются ударные фронты. Было показано, что такое воздействие приводит к механическому разрушению контролируемого объема ткани до состояния мелкодисперсной в...












