Кардиология №12 / 2015
О применении антиагреганта руциромаба для профилактики тромбозов при коронарной ангиопластике у больных ишемической болезнью сердца
ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
В ФГБУ «Российский кардиологический научно-производственный комплекс» (РКНПК) Минздрава России разработан препарат монафрам (российское непатентованное наименование руциромаб, ранее применявшееся название — до 2004 г. — ФраМон). Препарат представляет собой F(ab)′2-фрагменты моноклонального антитела ФраМон (другое название CRC64 [1]) против рецептора фибриногена тромбоцитов — комплекса гликопротеинов (ГП) IIb—IIIa. Монафрам относится к фармакологической группе антиагрегантов, а по механизму действия — к антагонистам ГП IIb—IIIa. Препарат монафрам был разрешен для клинического применения в Российской Федерации в 2004 г. и с тех пор успешно используется для лечения и профилактики острых и подострых тромбозов, а также у больных, которым проводится процедура коронарной ангиопластики.
За последние 3 десятилетия процедура чрескожной транслюминальной коронарной ангиопластики (ЧТКА), в первую очередь стентирования, стала одной из самых массовых при ведении больных ишемической болезнью сердца (ИБС). С одной стороны, она позволяет улучшить отдаленный прогноз, предотвращая развитие инфаркта миокарда (ИМ) и внезапную сердечную смерть, а с другой — способствует уменьшению частоты и интенсивности приступов стенокардии.
В настоящее время более 90% всех случаев ЧТКА завершаются стентированием. Самым тяжелым осложнением стентирования является тромбоз стента, наблюдаемый примерно в 0,87—2,2% случаев и клинически проявляющийся ИМ, нестабильной стенокардией или внезапной коронарной смертью. По времени возникновения внутристентовые тромбозы разделяют на острые (в пределах 24 ч после ангиопластики), подострые (от 24 ч до 30 сут), поздние (от 30 сут до 12 мес) и очень поздние (более 12 мес после проведения процедуры).
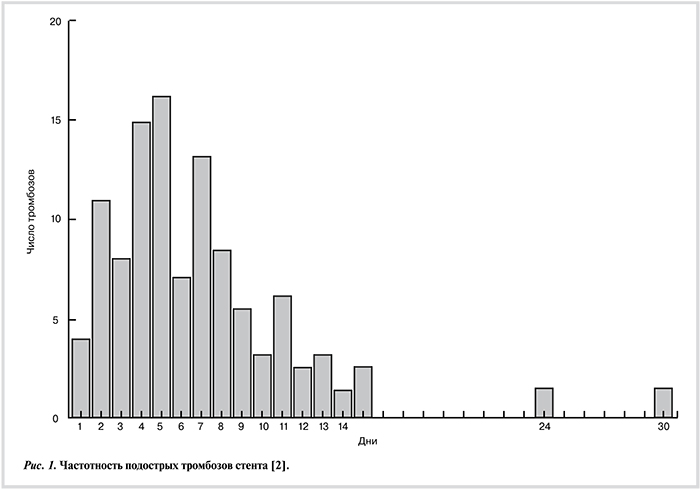
К основным причинам острого и подострого тромбоза стента относятся факторы, связанные непосредственно с состоянием больного (сахарный диабет, острый коронарный синдром (ОКС), пожилой возраст, низкая фракция выброса, неадекватная коагуляция во время ЧТКА, серьезные кардиальные осложнения в течение 30 дней после процедуры, перенесенный ИМ, резистентность к антиагреганту, прекращение приема антиагрегантов, реакция гиперчувствительности к использованным в стенте материалам), с процедурой и техникой вмешательства (феномен замедленного или отсутствующего кровотока после стентирования — slow-reflow/no-reflow), неполное раскрытие стента, остаточная диссекция интимы, методика «crush» бифуркационного стентирования, окклюзия боковой ветви, замедленное заживление сосудистой стенки, протрузия ткани сквозь ячейки стента в просвет сосуда, неиспользование ингибиторов ГП IIb—IIIa), а также факторы, связанные с поражением коронарных артерий (атеросклеротическое поражение типа С, рестеноз внутри стента, кальциноз, тотальная окклюзия, бифуркационное или многососудистое поражение, стеноз венозного шунта, большая протяженность стентированного сегмента). Частота острых тромбозов составила 32%, подострых — 41%. На рис. 1 отражена частота возникновения подострых тромбозов стента в зависимости от числа дней после ЧТКА у больных ИМ с подъемом сегмента ST (ИМпST) [2].
Поздние внутристентовые тромбозы нередко развиваются в связи с преждевременным прекращением приема антиагрегантов, а очень поздние — с ингибированием процесса эндотелизации стента. На долю тех и других приходится около 26% всех случаев.
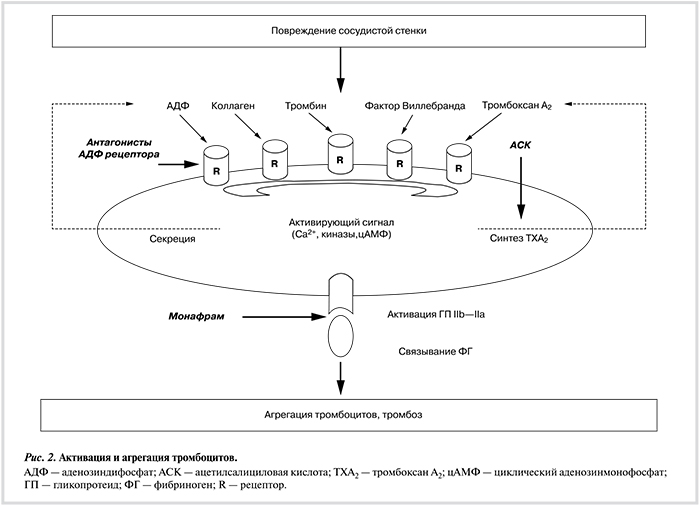
Антагонисты рецепторов ГП IIb—IIIa — наиболее мощные антитромбоцитарные препараты, блокирующие конечную и ключевую стадию агрегации тромбоцитов — связывание фибриногена с его рецептором — ГП IIb—IIIa (интегрином αIIbβ3), экспрессирующимся на мембранах тромбоцитов. Способность к связыванию фибриногена и некоторых других лигандов (фактора Виллебранда, фибронектина) этот рецептор приобретает в результате активации тромбоцитов в местах повреждения сосудов такими соединениями, как аденозиндифосфат (АДФ), тромбоксан А2, коллаген, тромбин и другие протромбогенные агонисты. Фибриноген образует молекулярные связи между активированными тромбоцитами, что непосредственно приводит к их «склеиванию» и образованию агрегатов. Частичное подавление агрегации возможно в результате воздействия лекарственных средств, ингибирующих разные пути активации тромбоцитов, — ацетилсалициловой кислоты (АСК), предотвращающей образование тромбоксана А2, или антагонистов рецепторов P2Y12 АДФ (тиклопидин, клопидогрел, прасугрел и тикагрелор). Однако наиболее эффективное ингибирование агрегации наблюдается при блокаде рецепторной функции ГП IIb—IIIa. В отличие от АСК, ингибиторов рецептора АДФ и часто применяемой в клинической практике комбинации этих препаратов (АСК + клопидогрел или другой антагонист рецепторов АДФ) антагонисты ГП IIb—IIIa способны полностью блокировать агрегационный ответ тромбоцитов при воздействии практически всех, в том числе наиболее сильных агонистов, — тромбина и коллагена в высоких концентрациях.












