Урология №1 / 2016
Обоснование комбинированной медикаментозной терапии симптомов нижних моче-выводящих путей с использованием a1-адреноблокатора и М-холиноблокатора
Клиника урологии ГБОУ ВПО «Первый МГМУ им. И. М. Сеченова»; НИИ уронефрологии и репродуктивного здоровья человека ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова»
У большинства пациентов расстройства мочеиспускания обусловлены как механическими, так и функциональными факторами. Своевременное выявление характера уродинамических нарушений, в первую очередь инфравезикальной обструкции и гиперактивности детрузора, у больных доброкачественной гиперплазией предстательной железы имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения. a1-Адреноблокаторы являются первой линией терапии для мужчин с симптомами нижних мочевыводящих путей (СНМП) умеренной и тяжелой степеней выраженности. При выборе a1-адреноблокатора предпочтение следует отдавать более селективным представителям класса. Наряду с высокой эффективностью селективность a-адреноблокатора обеспечивает низкий процент побочных реакций, особенно со стороны сердечно-сосудистой системы. Так же как и α-адреноблокаторы, м-холиноблокаторы различаются по степени селективности в отношении воздействия именно на мочевой пузырь. Солифенацин более селективно по сравнению с толтеродином и оксибутинином взаимодействует с м-холинорецепторами мочевого пузыря. Селективность данного препарата выражается в относительно низкой частоте побочных эффектов, особенно возникновения сухости во рту при его применении, а также возможности длительной терапии. Комбинированное лечение a1-адреноблокатором и м-холиноблокатором может рассматриваться как вариант терапии пациентов с умеренными и тяжелыми СНМП с преобладанием симптомов наполнения, особенно если монотерапия оказалась недостаточно эффективной.
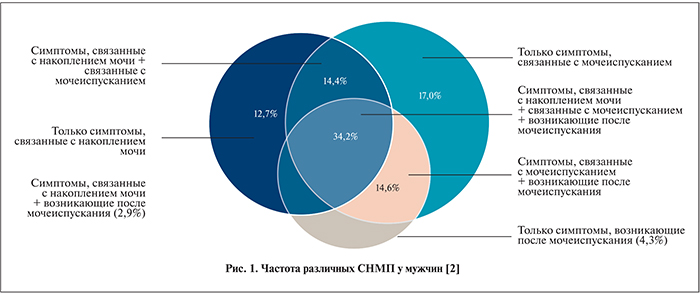
Для большинства пациентов расстройства мочеиспускания обусловлены как механическими, так и функциональными факторами. Хотя инфравезикальная обструкция (ИВО) вследствие доброкачественной гиперплазии предстательной железы (ДГПЖ) – наиболее частая причина расстройств мочеиспускания у пожилых мужчин, симптомы нижних мочевыводящих путей (СНМП) возможны и при других заболеваниях. Причиной развития симптомов наполнения и/или опорожнения могут стать нейрогенные нарушения, ятрогенные факторы и вмешательства на предстательной железе. Своевременное выявление уродинамических нарушений, в первую очередь ИВО и гиперактивности детрузора (ГД), у больных ДГПЖ имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения. По данным [1], у 49% мужчин с СНМП выявляются симптомы как опорожнения, так и накопления. До 80% пациентов с выраженной формой ИВО имеют ГД, которая отмечается в 2 раза чаще, чем у пациентов без ИВО. У большинства мужчин с СНМП наблюдается комбинация симптомов различных типов. Результаты опроса EpiLUTS в США, Великобритании и Швеции [2] показали, что СНМП, связанные с накоплением мочи, опорожнением мочевого пузыря и возникающие после мочеиспускания у пациентов, часто наблюдаются одновременно (рис. 1). Около 49% мужчин с СНМП сообщили о наличии комбинации симптомов, связанных с накоплением мочи и опорожнением мочевого пузыря.
Согласно классической физиологической концепции, функция мочевого пузыря обеспечивается антагонистическим взаимодействием симпатического и парасимпатического отделов нервной системы. Рецепторы в области окончаний симпатических нервов мочевого пузыря и мочеиспускательного канала в зависимости от физиологических эффектов, возникающих при их стимуляции, разделяются на α- и β-адренорецепторы. Парасимпатическая нервная система представлена м-холинорецепторами. Гладкая мускулатура мочевого пузыря человека содержит смешанные популяции м2- и м3-подтипов холинорецепторов.
В адренергических синапсах передача возбуждения осуществляется посредством медиатора норадреналина.
В пределах периферической иннервации норадреналин принимает участие в передаче импульсов с адренергических (симпатических) нервов на эффекторные клетки. В ответ на нервные импульсы происходит высвобождение норадреналина в синаптическую щель с последующим взаимодействием его с адренорецепторами (АР) постсинаптической мембраны. Адренергические рецепторы находятся в ЦНС и на мембранах эффекторных клеток, иннервируемых постганглионарными симпатическими нервами. Антагонисты α1-АР (α-адреноблокаторы) – одни из самых эффективных препаратов для лечения пациентов с СНМП, вызванными ДГПЖ (СНМП/ДГПЖ). На основании анализа результатов лечения они были признаны Американской урологической ассоциацией препаратами выбора для терапии ДГПЖ [3].
Теория о существовании в симпатической автономной нервной системе двух классов АР, α и β, впервые была выдвинута в 1948 г. [4, 5]. В конце 1960-х гг. β-АР дополнительно разделили на два подтипа [6]. Уже в 1970-х гг. было высказано предположение, будто основным типом β-АР мочевого пузыря человека является третий тип β-АР (не-β1 или -β2) [7]. С конца XIX в. известно, что мочевой пузырь иннервируется как парасимпатической, так и симпатической автономной нервной системой [8]. В конце 1980-х гг. β3-АР были открыты и впервые обнаружены в жировой ткани, где, как было показано на моделях у животных, они участвовали в липолизе и терморегуляции [9]. Функциональная роль β3-АР в мочевом пузыре человека была подтверждена спустя 20 лет [10, 11]. Все три типа β-АР экспрессируются в мочевом пузыре человека, но 97% всех мРНК β-АР в мочевом пузыре относятся к подтипу β3-АР [12].
β-Адренорецепторы являются сопряженными с G-белком рецепторами норадреналина и адреналина – основных нейромедиаторов симпатической автономной нервной системы. В мочевом пузыре фаза наполнения цикла мочеиспускания регулируется прежде всего симпатической нервной системой [13]. Опорожнение мочевого пузыря, напротив, стимулируется высвобождением ацетилхолина в парасимпатических нервных окончаниях [14].
Наиболее часто применяемыми в урологической практике α-адреноблокаторами являются (оригинальные препараты) тамсулозин (Омник, Омник Окас), теразозин (Сетегис), доксазозин (Кардура), альфузозин (Дальфаз) и силодозин (Урорек) [15–18]. Многие непрямые сравнения между плацебо-контролируемыми исследованиями, так же как и не столь многочисленные прямые сравнительные исследования продемонстрировали одинаковую эффективность двух высокоселективных α1-адреноблокаторов (тамсулозин и силодозин) при использовании их адекватных дозировок [19]. С другой стороны, α1-адреноблокаторы отличаются переносимостью: селективный α1-адреноблокатор тамсулозин пациенты переносят лучше, чем другие α1-адреноблокаторы без подтиповой селективности, например ...












