Фарматека №13 (286) / 2014
Оценка эффективности тиоктовой кислоты в коррекции чувствительных нарушений при хронической воспалительной демиелинизирующей полирадикулоневропатии
(1) ГБОУ ДПО «Казанскаягосударственнаямедицинскаяакадемия» Минздрава России, Казань; (2) Республиканский клинико-диагностический центр по демиелинизирующим заболеваниям Минздрава Республики Татарстан, Казань
Чувствительные нарушения – основа клинических проявлений хронической воспалительной демиелинизирующейполирадикулоневропатии (ХВДП), обусловливающие инвалидизацию больных, поэтому разработка эффективных методов их лечения представляется актуальной и перспективной. Представлены результаты исследования эффективности и переносимости 12-недельного курса лечения тиоктовой кислотой больных ХВДП. Было показано, что применение тиоктовой кислоты при ХВДП на фоне базисной терапии сопровождается уменьшением выраженности и замедлением прогрессирования чувствительных нарушений, что позволяет рекомендовать использовать данный препарат в рутинной практике.
Дизиммунные полиневропатии (ДП) – обширная группа аутоиммунных заболеваний периферической нервной системы, различающихся клиническими проявлениями, типом течения и эффективностью оказываемого лечения. К наиболее распространенным ДП относится хроническая воспалительная демиелинизирующая полирадикулоневропатия (ХВДП), которая в классической форме характеризуется хронической прогрессирующей или рецидивирующей проксимальной и дистальной слабостью и нарушениями чувствительности, снижением или отсутствием проприорефлексов во всех четырех конечностях, а иногда поражением черепных нервов, развивающимся на протяжении не менее 2 месяцев [1].
Расстройства чувствительности при ХВДП отличаются своим клиническим многообразием и зачастую представляют собой первое клиническое проявление в дебюте, в некоторых случаях ХВДП доминируют в течение всей болезни. В развернутой форме заболевания развиваются нарушения поверхностной (болевой, температурной) и глубокой чувствительности (вибрационной, мышечно-суставной) в конечностях по полиневритическому типу. Субъективно больных беспокоят как позитивные (чувство жжения, парастезии и болевой невропатический синдром), так и негативные сенсорные расстройства (чувство онемения, снижение болевой, температурной или вибрационной чувствительности). При выпадении глубокой чувствительности в конечностях у больных появляется выраженная сенситивная атаксия, которая в сочетании с парезами конечностей обусловливает значительную инвалидизацию больных и ограничение их повседневной активности [2].
Базисное лечение ХВДП комплексное и включает препараты, действие которых направлено на снижение активности дизиммунного процесса. К первой линии лечения относят глюкокортикоиды (метилпреднизолон), иммуноглобулин человека нормальный для внутривенного введения и плазмаферез. При недостаточной эффективности прибегают к комбинации препаратов первой линии либо используют терапию второй линии (метотрексат, ритуксимаб и др.) [3].
Немаловажную роль в лечении ХВДП играет симптоматическая терапия, направленная на уменьшение выраженности двигательных нарушений, купирование позитивных и негативных сенсорных нарушений, включая невропатические боли, купирование астении, патологической утомляемости, коморбидных аффективных расстройств.
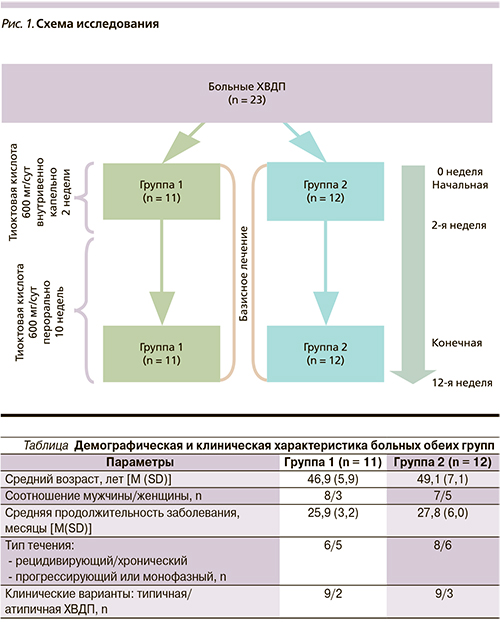
В аспекте симптоматической коррекции чувствительных нарушений при ХВДП весьма перспективным представляется использование тиоктовой кислоты (альфа-липоевая кислота, Эспа-Липон; Эспарма ГмбХ, Германия). Согласно современным данным, механизмы действия тиоктовой кислоты сводятся к нормализации энергетического обмена нейронов, восстановлению аксонального транспорта, стабилизации клеточных мембран, инактивации свободных радикалов и подавлению их образования. Классически препарат применяют в лечении диабетической и алкогольной полиневропатии, тем не менее терапевтический потенциал препарата этими нозологиями н...












