Акушерство и Гинекология №6 / 2019
Оценка качества эмбриона по профилю экспрессии малых некодирующих РНК в культуральной среде эмбриона в программах ВРТ
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва
Цель исследования. Изучение профиля малых некодирующих РНК (microRNA и piwiRNA) в культуральной среде эмбриона на 4-е сутки культивирования для идентификации потенциальных биомаркеров качества эмбриона.
Материалы и методы. Применен метод глубокого секвенирования для идентификации спектра малых некодирующих РНК (мнРНК), присутствующих в полости бластоцисты и в культуральной среде эмбриона, количественная оценка которых в 48 образцах культуральной среды эмбрионов, перенесенных в полость матки, была проведена методом полимеразной цепной реакции с обратной транскрипцией в реальном времени.
Результаты. С помощью дискриминантного анализа методом частных наименьших квадратов (PLS-DA)
был проанализирован вклад шести мнРНК в определение качества эмбриона, характеризуемый значением параметра важности переменной в проекции (variable importance in projection - VIP). В результате анализа было выявлено, что наибольший вклад имеют четыре мнРНК: piR020401 (VIP=1,46027), let-7c-5p (VIP=1,17416), let-7b-5p (VIP=0,994657), let-7i-5p (VIP=0,942665), а наименьший: miR-143-5р (VIP=0,623108) и miR-92a-3p (VIP=0,471951). Методом ранговой корреляции по Спирмену выявлена статистически значимая корреляция между уровнем экспрессии мнРНК (hsa-let-7b-5p, hsa-let-7c-5p, hsa-piR020401) в среде культивирования и качеством переносимого в полость матки эмбриона. Использование непараметрического критерия Манна—Уитни выявило статистически значимые отличия уровня экспрессии piR020401 и miR-92a-3p в среде культивирования эмбрионов, формирующих группы по морфофункциональным параметрам.
Заключение: мнРНК (let-7c-5p, let-7b-5p, piR020401), обнаруженные в культуральной среде, статистически значимо коррелируют с морфофункциональными характеристиками эмбриона на 4 сутки после оплодотворения, среди которых наибольший вклад в определение качества эмбриона вносит piR020401. Уровень экспрессии miR-92a-3p и piR020401 в культуральной среде зависит от стадии развития эмбриона, дифференцируя стадию морулы и бластоцисты. Учитывая, что отставание в скорости развития эмбриона к пятым суткам культивирования не всегда предопределяло отсутствие имплантации эмбриона в матку, ориентироваться исключительно на морфологические параметры эмбриона при выборе кандидата на перенос в полость матки нецелесообразно, а рекомендуется дополнительно оценивать профиль экспрессии let-7c-5p, let-7b-5p, miR-92a-3p, piR020401 на 4 сутки культивирования эмбриона. Таким образом, полученные данные позволяют оптимизировать выбор эмбриона и проведение программы вспомогательных репродуктивных технологий.
Стремительное развитие вспомогательных репродуктивных технологий (ВРТ) обусловлено все еще высоким уровнем бесплодия в современном обществе [1]. Несмотря на многие успешные попытки улучшить демографическую ситуацию, доля бесплодных браков на территории России колеблется от 8 до 17,5% и в настоящее время не имеет тенденции к снижению [2]. На сегодняшний день ВРТ занимают ведущее место среди современных методов лечения бесплодия.
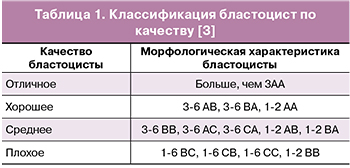 Для наступления беременности в программах ВРТ одна из важнейших задач — выбор наиболее качественного и жизнеспособного эмбриона для переноса в полость матки. Селекция таких эмбрионов, как правило, осуществляется на основании оценки их морфологических свойств. Общепринятый стандарт оценки качества бластоцист, предложенный Gardner et al [3], приведен в табл. 1.
Для наступления беременности в программах ВРТ одна из важнейших задач — выбор наиболее качественного и жизнеспособного эмбриона для переноса в полость матки. Селекция таких эмбрионов, как правило, осуществляется на основании оценки их морфологических свойств. Общепринятый стандарт оценки качества бластоцист, предложенный Gardner et al [3], приведен в табл. 1.
Однако критерии качества, предложенные Gardner et al, являются субъективными, а точность такого метода отбора эмбрионов остается недостаточно высокой. Более того, не все эмбрионы «хорошего» и «отличного» качества, с точки зрения морфологических критериев, при переносе в нормальный эндометрий полости матки приводят к беременности [4]. Таким образом, возникает необходимость внедрения дополнительных неинвазивных технологий селективного выбора эмбриона с максимальным имплантационным потенциалом.
За последние годы было изучено значительное число потенциальных биомаркеров качества эмбрионов и их имплантационной способности. Многообещающим методом выступает преимплантационное генетическое тестирование, так как хромосомная патология у переносимых эмбрионов может быть основной причиной неудачных результатов лечения бесплодия. Однако, наряду с бесспорной ценностью, данный метод имеет ограничения для применения в повседневной практике за счет его высокой стоимости, а также необходимости инвазивных вмешательств на эмбрионе [5].
Представление об энергетической, метаболической активности и состоянии сигнальных систем конкретного эмбриона без использования инвазивных методик позволяет получить среда культивирования эмбрионов на различных стадиях развития [6]. Значительным диагностическим и прогностическим потенциалом в отношении качества эмбриона и его имплантационной способности обладают малые некодирующие РНК (мнРНК) при определении уровня их экспрессии в культуральной среде эмбриона [7]. мнРНК действуют на эпигенетическом, транскрипционном и посттранскрипционном уровнях регуляции экспрессии генов. Именно эти взаимодействия определяют различный фенотип и функции клеток организма [8]. Влиянием на фенотип и функцию клеток в большей степени обладают такие мнРНК, как microRNA и piwiRNA [9]. Было доказано, что определение экспрессии данных молекул в культуральной среде эмбриона позволяет прогнозировать его имплантационный потенциал и более точно оценить качество эмбриона [10]. В 2014 г. McCallie et al. [11] впервые выявили, что бластоцисты у пациентов, страдающих бесплодием на фоне СПКЯ, имеют атипичный профиль microRNA (miR-19a, miR-19b, miR-24, miR-92, miR-93 и т.д.), а в 2016 г. Capalbo et al. [12] показали, что внутриклеточная экспрессия microRNA различается у эуплоидных и анеуплоидных эмбрионов. В исследовании Liang et al. [13] было продемонстрировано, что повышенная экспрессия miR-24 в культуральную среду ассоциирована с остановкой бластоцисты в развитии и коррелирует с качеством эмбриона. Таким образом, наличие взаимосвязи между качеством эмбриона и конкретными мнРНК в культуральной среде данных эмбрионов — перспективный и современный метод оптимизации выбора эмбриона при проведении программ ВРТ.
Материалы и методы
49 образцов культуральной среды были собраны на 4-е сутки после оплодотворения от эмбрионов класса А, В и С, согласно морфофункциональной классификации бластоцист, предложенной Gardner et al, а также от эмбрионов на стадии морулы и кавернозной морулы. От эмбрионов класса А было получено 27 образцов культуральной среды, 8 образцов — от эмбрионов класса В, 4 образца — от эмбрионов класса С; оставшиеся 10 образцов соответствовали среде культивирования, полученной от 7 морул и от 3 кавернозных морул. Из собранных образцов были выделены РНК колоночным способом с использованием набора «miRNeasy Serum/Plasma Kit» (Qiagen). Идентификация всех имеющихся мнРНК в среде культивирования эмбриона была осуществлена методом глубокого секвенирования с использованием набора по синтезу кДНК-библиотек NEBNext® Multiplex Small RNA Library Prep Set for Illumina® (Set11, New England Biolab®, Germany) на платформе NextSeq 500 platform (Illumina, USA). Относительный уровень экспрессии кДНК оценивали по кратности изменения (КИ) методом ΔΔCt.
M0s1 / M0s2 = 2-∆∆Ct,
где M0s1 и M0s2 – исходные количества кДНК в образцах s1 и s2, ∆∆Сt=(Cts1-Ctnorm1)-(Cts2-Ctnorm2), Ct — значение цикла амплификации в точке пересечения кинетической кривой накопления продукта амплификации с линией порогового уровня флуоресценции, который определяется автоматически программным обеспечением амплификатора StepOnePlus; Cts...












