Фарматека №6 / 2024
Оценка риска рецидива люминального HER2-отрицательного рака молочной железы и возможности интенсификации адъювантной гормонотерапии для снижения риска прогрессирования
Федеральный научно-клинический центр физико-химической медицины им. акад. Ю.М. Лопухина, Москва, Россия
Основой лечения люминального HER2-отрицательного рака молочной железы (РМЖ) – самого распространенного подтипа РМЖ – является гормонотерапия, которую назначают на 5–10 лет после проведения радикального лечения. Несмотря на проведение такого длительного лечения, одна из 3–4 пациенток со II стадией и одна из 2–3 пациенток с III стадией сталкиваются с рецидивом, который может произойти в течение 20 лет после постановки первичного диагноза. Риск рецидива зависит от таких характеристик опухоли, как степень злокачественности, уровень пролиферативной активности, степень поражения регионарных лимфатических узлов и др. С целью снижения этого риска на данный момент используется несколько стратегий интенсификации адъювантной гормональной терапии. К ним относятся овариальная супрессия, продленное назначение гормональной терапии, а также назначение ингибиторов CDK4/6. В данной статье представлен обзор факторов риска рецидива и существующих на данный момент стратегий адъювантной гормонотерапии.
Введение
Лечение рака молочной железы (РМЖ) – это вопрос, актуальность которого обусловлена лидирующими позициями данной нозологии в структуре заболеваемости и смертности от онкологических заболеваний среди женщин [1–4].
Люминальный HER2-отрицатель-ный РМЖ является наиболее распространенным подтипом, встречающимся у 60–70% пациенток. Этот подтип характеризуется наличием в раковых клетках рецепторов эстрогена и/или прогестерона, а также отсутствием белка HER2. Согласно российским и международным рекомендациям, основой лечения этого подтипа является гормонотерапия, которую назначают на 5–10 лет после завершения радикального (хирургического) лечения [6–8]. Проведение адъювантной гормональной терапии (АГТ) после радикального оперативного вмешательства позволяет увеличивать показатели выживаемости пациенток с HR+ (hormone receptor positive, положительный по экспрессии гормональных рецепторов) РМЖ [9]. Однако, несмотря на проводимое лечение, риск рецидива РМЖ сохраняется на протяжении 20 лет: до 37% пациенток со II стадией заболевания и до 57% – с III стадией сталкиваются с рецидивом заболевания [10].
Наиболее значимыми факторами риска прогрессирования для люминального HER2-отрицательного РМЖ являются молодой возраст пациентки, размер первичной опухоли, степень дифференцировки (злокачественности), наличие лимфоваскулярной или периневральной инвазии, статус регионарных лимфатических узлов, а также уровень Ki-67 (табл. 1) [11–15].
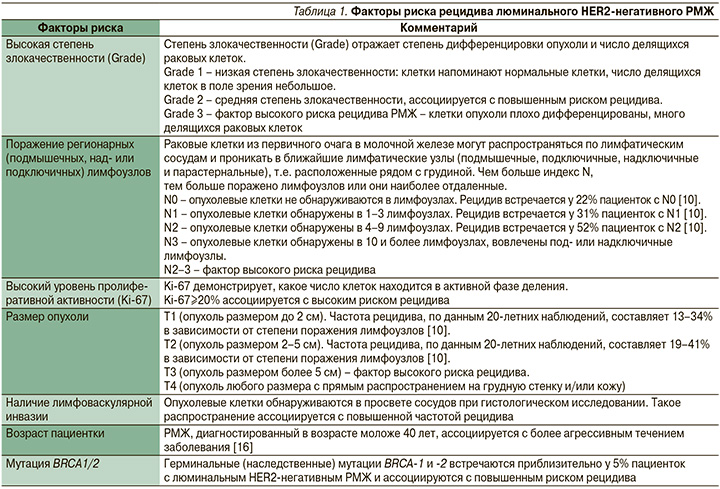
В настоящий момент для пациенток с неоднозначным клиническим риском прогрессирования в США и Европе используются прогностические тестовые системы (Oncotype, MammaPrint), не зарегистрированные в РФ [16–17]. Решение о проведении адъювантной химиотерапии (ХТ) у пациенток с люминальным HER2-негативным РМЖ в РФ принимается на основании наличия вышеперечисленных факторов риска и их комбинации.
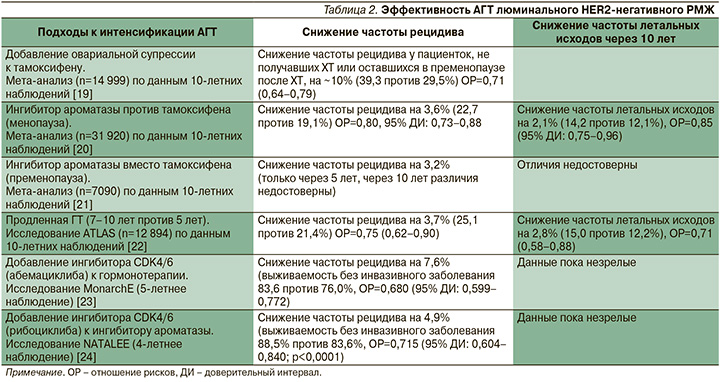
Также разрабатываются стратегии интенсификации АГТ, цель которых заключается в улучшении имеющихся результатов лечения. Они включают выключение функции яичников, продление сроков проведения АГТ, а также добавление к проводимому лечению ингибитора CDK4/6. В данном обзоре обсуждаются подходы к интенсификации АГТ у пациенток с люминальным HER2-отрицательным РМЖ.
Овариальная супрессия
Само по себе функционирование яичников как гормонопродуцирующего органа может быть фактором риска для пациенток с гормонозависимыми опухолями.
В исследованиях SOFT и TEXT изучалась роль овариальной супрессии (ОС) у пременопаузальных пациенток с люминальным HER2-отрицательным РМЖ, получавших АГТ [25]. В 3 группы были рандомизированы 3047 пациенток: тамоксифен, ОС+тамоксифен и ОС+эксеместан (SOFT), 2660 были рандомизированы в 2 группы: ОС+тамоксифен и ОС+эксеместан (TEXT). В финальный анализ вошли результаты лечения 4690 пациенток.
Спустя 12 лет наблюдения в популяции SOFT отмечалась статистически большая выживаемость без прогрессирования (ВБП) у пациенток, получавших ОС+тамоксифен, по сравнению с тамоксифеном: 76,1 против 71,9% (p=0,009). Для группы, получавшей ОС+эксеместан, этот показатель составил 79,0% [26].
Также были опубликованы результаты общей выживаемости (ОВ), которые продемонстрировали, что у пациенток высокой группы риска (необходимость проведения ХТ, возраст до 35 лет, опухоль более 2 см, высокая степень злокачественно...












