Кардиология №8 / 2015
Оценка состояния атеросклеротических бляшек у больных с острым коронарным синдромом без подъема сегмента ST
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
Сердечно-сосудистые заболевания, в том числе острый коронарный синдром (ОКС), несмотря на успехи современного лечения, продолжают оставаться ведущей причиной смертности в мире. Структура атеросклеротической бляшки (АСБ) наряду со степенью стеноза просвета коронарной артерии (КА) и некоторых других условий играет первостепенную роль в патогенезе нестабильной стенокардии (НС) и инфаркта миокарда (ИМ). Данные гистологических исследований показали, что наиболее часто встречающимся морфологическим типом нестабильной АСБ является фиброатерома с тонкой капсулой [1—3].
С появлением данных о структурных особенностях нестабильных АСБ стали развиваться методы, позволяющие их визуализировать, и прежде всего — внутрисосудистое ультразвуковое исследование (ВСУЗИ) и оптико-когерентная томография (ОКТ). Мультиспиральная компьютерная томография (МСКТ) КА из-за низкого временно'го и пространственного разрешения долгое время находилась в стороне от реализации подобных задач, несмотря на ряд преимуществ, к которым можно отнести неинвазивность и относительную простоту исполнения метода. В последнее десятилетие одновременно с появлением более современных томографов с улучшенными техническими характеристиками стали появляться работы, посвященные выявлению компьютерно-томографических (КТ-) признаков нестабильности АСБ.
К описанным критериям можно отнести положительное ремоделирование (высокий индекс ремоделирования), низкую плотность АСБ (менее 30 HU), наличие микрокальцинатов в виде депозитов размерами менее 3 мм, неровный контур, а также «кольцевидное контрастирование», не превышающее 130 HU [4—9]. Вместе с тем до сих пор окончательно не определено значение каждого из признаков, как и не найдены их сочетания, позволяющие отличить стабильную АСБ от нестабильной.
Целью нашей работы были оценка состояния АСБ в КА и выявление возможных признаков их нестабильности у больных с ОКС.

Материал и методы
Клинический материал. Путем проспективного набора в исследование включали больных, поступающих в блок интенсивной терапии отделения неотложной кардиологии с подозрением на ОКС без стойкого подъема сегмента ST. Диагнозы «инфаркт миокарда» и «нестабильная стенокардия» устанавливали согласно общепринятым критериям [10]. ИМ без подъема сегмента ST диагностировали при выявлении новой депрессии сегмента ST >0,1 мВ или инверсии зубца Т по меньшей мере до 0,3 мВ более чем в 2 смежных отведениях, сопровождающихся повышением уровня тропонина выше 99-го процентиля. НС диагностировали при наличии типичной клинической картины прогрессирующей стенокардии на уровне III—IV функционального класса, впервые возникшего ангинозного приступа или ранней постинфарктной стенокардии без повышения уровня тропонина в крови.
 В исследование не включали больных с тяжелыми осложнениями основного заболевания, в том числе отеком легких, кардиогенным шоком, а также тахиаритмиями и бради-аритмиями с нерегулярным ритмом сердца, наличием доказанной аллергической реакции на контрастный препарат, почечной недостаточностью со снижением скорости клубочковой фильтрации <50 мл/мин и перенесенной операцией коронарного шунтирования или имплантацией более одного стента в анамнезе.
В исследование не включали больных с тяжелыми осложнениями основного заболевания, в том числе отеком легких, кардиогенным шоком, а также тахиаритмиями и бради-аритмиями с нерегулярным ритмом сердца, наличием доказанной аллергической реакции на контрастный препарат, почечной недостаточностью со снижением скорости клубочковой фильтрации <50 мл/мин и перенесенной операцией коронарного шунтирования или имплантацией более одного стента в анамнезе.
Первоначально в исследование были включены 90 больных с подозрением на ОКС. После проведения МСКТ были исключены пациенты с плохим качеством изображения, массивным кальцинозом КА, а также больные, у которых отсутствовали гемодинамически значимые стенозы КА и впоследствии был исключен диагноз «ОКС». Таким образом, в общую группу вошли 70 больных — 48 (68,6%) с НС и 22 (31,4%) с ИМ. Клинические характеристики больных представлены в табл. 1.
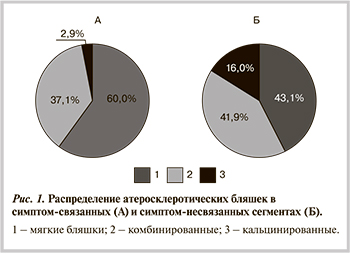
При анализе данных МСКТ за симптом-связанный сегмент КА во всех случаях принимали только один сегмент артерии, кровоснабжающей зону инфаркта или ишемии миокарда, выявляемых на основании данных электро- и эхокардиографии (локальные зоны нарушения сократимости), нагрузочных тестов и инвазивной коронарографии. В случае обнаружения в артерии нескольких АСБ, симптом-связанной считали ту, которая вызвала наибольшее сужение просвета сосуда.
МСКТ КА выполняли всем пациентам на 1—3-и сутки заболевания до проведения инвазивной коронарографии на томографе с 64 рядами детекторов. В качестве контрастного препарата использовали ультравист из расчета 1,5 мл на 1 кг массы тела больного. Препарат вводили внутривенно со скоростью 5 мл/с автоматическим шприцем. Исследование выполняли в 2 фазы: нативную (до введения контрастного препарата) и артериальную, во время которой вводили контрастный препарат. Нативную фазу выполняли в пошаговом режиме с силой тока 100 мА, напряжением 120 кВ и толщиной среза 3 мм. Время полуоборота трубки составило 250 мс. После выполнения первой фазы проводили визуальную оценку степени выраженности кальциноза КА для определения целесообразности выполнения второй фазы. Артериальную фазу выполняли в спиральном режиме с получением 64 срезов шириной 0,5 мм с силой тока 400 мА и напряжением 120 кВ. Время полуоборота трубки составило 400 мс. Оценку сте...












