Фарматека №10 (303) / 2015
Окислительный стресс и перспективы нейропротекции при хронических нарушениях мозгового кровообращения
ФГБНУ «Научный центр неврологии», Москва
Целью исследования являлось изучение нейропротекторного эффекта Милдроната у пациентов с хроническими формами нарушений мозгового кровообращения. Оценивали динамику клинического статуса и перекисного окисления липидов у 67 больных дисциркуляторной энцефалопатией, последствиями ишемического инсульта на фоне атеросклероза (22 пациента) и умеренной артериальной гипертензии до и после 20-дневного курса лечения Милдронатом в суточной дозе 500 мг парентерально. В большинстве наблюдений выявлено положительное влияние Милдроната на когнитивные функции, кохлео-вестибулярный, астено-невротический и цефалгический синдромы. Получено подтверждение экспериментальных данных об антиоксидантном действии Милдроната, которое реализуется путем повышения эндогенного антиоксидантного статуса организма. Сделан вывод, что Милдронат может быть рекомендован к применению в комплексной терапии пациентов с хроническими нарушениями мозгового кровообращения.
Многообразие этиологических факторов и патогенетических механизмов, участвующих в развитии нарушений мозгового кровообращения (НМК), определяет сложность выбора терапии. В то же время независимо от причин, вызывающих ишемию мозга, пути реагирования его метаболизма на ишемию универсальны [1].
Мозг человека, на долю которого приходится 2% от общей массы тела, утилизирует 95% всего потребляемого кислорода, при этом интенсивность потребления его нейронами в десятки и сотни раз превышает таковую в клетках других тканей и органов (350–450 мкл кислорода на 1 г ткани мозга в 1 минуту). Мембраны нейронов характеризуются высоким содержанием арахидоновой и докозагексаеновой кислот, окисляющихся под действием активных форм кислорода [2].
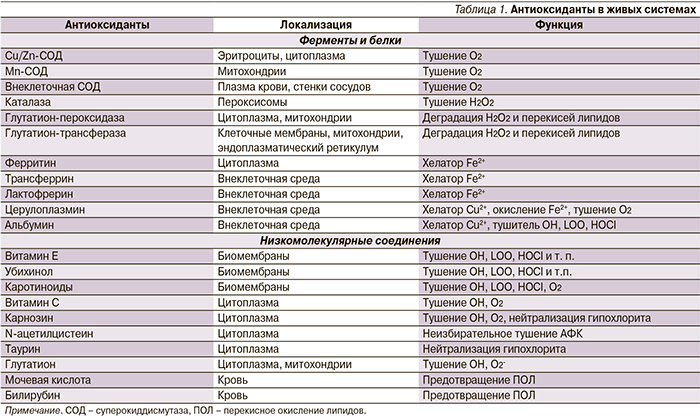
В нормальных физиологических условиях содержание высокореакционных кислородных радикалов уравновешивается эндогенной антиоксидантной системой. В ее состав входят как ферменты, так и многочисленные низкомолекулярные антиоксиданты или соединения, препятствующие образованию свободных радикалов (табл. 1) [2].
Нарушения кровоснабжения мозга инициируют каскад метаболических нарушений, среди которых ключевое место занимают реакции свободнорадикального окисления белков, нуклеиновых кислот и липидов активными формами кислорода (АФК). Накопление высокотоксичных продуктов окисления оказывает системное воздействие не только на клеточные мембраны, но и на нейроны в целом, приводя их к гибели [3, 4].
Окисление мембранных фосфолипидов, которые содержат ненасыщенные жирнокислотные остатки, происходит по цепному механизму. Эти процессы приводят к быстрому нарушению целостности клеточных мембран, не совместимому с жизнеспособностью клетки. Молекулярными продуктами окисления фосфолипидов являются гидропероксиды жирных кислот, а также соединения альдегидной природы – гидроксиноненали и малоновый диальдегид. При нормальных условиях функционирования концентрация этих соединений в тканях мала, но в условиях нарушения клеточного метаболизма создается ситуация, характеризующаяся повышенной продукцией АФК и носящая название окислительного стресса [1–4].
Процессы деструкции белков и нуклеиновых кислот под действием АФК могут происходить параллельно с деструкцией мембранных липидов. В окислительную модификацию белков вовлекаются различные аминокислотные радикалы. Амино- и сульфгидрильные группы белков особенно легко окисляются АФК и гипохлоритом. Этот вид модификации является, как правило, обратимым и зависит от энергетического потенциала клетки и наличия в ней восстановленных форм глутатиона, цистеина, тиоредоксина. Окисление белков может приводить к нарушению и модификации их функции. Так, влияние АФК на Na/K-АТФазу вызывает утрату чувствительности фермента к регулирующему действию АТФ; окислительная атака SH-групп NMDA-рецепторов приводит к подавлению их функции, что отражает контроль за экзайтотоксическими эффектами глутамата со стороны АФК. Фермент ксантиндегидрогеназа модифицируется в условиях окислительного стресса двумя различными способами. Она превращается в ксантиноксидазу и начинает продуцировать супероксид-анион, что приводит к увеличению внутриклеточного уровня АФК [2, 5].
Кроме цистеина в белковых молекулах легко окисляются лизин, тирозин и карбоксильные группы дикарбоновых аминокислот. В ходе разнообразных реакций накапливаются орто- и метатирозин, метионинсульфоксид, а также разнообразные карбонильные производные белков. Белки легко взаимодействуют с сахарами, что приводит к накоплению гликированных продуктов. Гликирование белков обычно осуществляется в результате прямого взаимодействия сахаров с аминогруппами лизина (наиболее легко гликируются те радикалы лизина, соседней группой которых является пролин). В результате образуются Шиффовы основания, которые при перегруппировке превращаются в стабильные соединения (продукты Амадори). Вместе с продуктами ПОЛ они накапливаются в липофусциновых гранулах, образующихся в нейронах. Радикальная атака нуклеиновых оснований в ДНК и РНК приводит к гидроксилированию и нарушает регулярную упаковку двойной спирали ДНК или стабильность РНК. Это вызывает фрагментацию молекул нуклеиновых кислот – дефекты, которые с трудом поддаются репарации [5].
Разработка проблемы защиты мозга от ишемии стала приоритетным направлением современной ангионеврологии.
Милдронат (3-(2,2,2-триметилгидразиний) пропионата дигидрат) является конкурентным ингибитором γ-бутиробетаингидроксилазы. Действие Милдроната обусловлено его антиоксидантным и мембранопротекторным эффектами, которые обеспечиваются следующими путями [6]:
- Ингибирует свободнорадикальное окисление липидов клеточных мембран, стабилизирует клеточные мембраны.
- Повышает активность антиоксидантных ферментов, в частности СОД.
- Ингибирует свободнорадикальную стадию синтеза простагландинов.
Материал и методы исследования
Под наблюдением находились 67 больных в возрасте от 45 до 76 лет, страдающих артериальной гипертензией в сочетании с атеросклерозом. Длите...












