Фарматека №10 / 2024
Определение молекулярно-генетических биомаркеров как путь повышения эффективности лечения и совершенствования профилактики обострений атопического дерматита
1) Российская медицинская академия непрерывного профессионального образования, Москва, Россия;
2) Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет), Москва, Россия
В статье представлены данные молекулярно-генетического исследования – определения полиморфизма генов детоксицирующих ферментов глутатион S‑трансфераз GSTM1, GSTT1 и GSTP1 у пациентов с атопическим дерматитом.
Выявлены фенотипические особенности у пациентов с атопическим дерматитом в зависимости от генотипов GSTT1, GSTM1 и GSTP1; показано, что генотипы GSTT0/0, GSTM0/0 и GSTPVal/Val или их сочетания достоверно чаще встречаются у пациентов с ранним дебютом заболевания, с отягощенными семейным и аллергологическим анамнезами и склонностью кожного процесса к частым обострениям. Установлено, что у большинства обследованных пациентов (31 человек из 52, или 59,6%) сочетания генотипов GSTT0/0+GSTM0/0 и GSTPIle/Val или GSTPVal/Val достоверно чаще являются прогностическим фактором склонности кожного процесса к частым обострениям.
Обнаружение у пациентов с атопическим дерматитом нулевых и неактивных генотипов GSTM1, GSTT1, GSTP1 указывают на целесообразность назначения активных персонализированных профилактических мероприятий по ограничению контакта с конкретными экзогенными ксенобиотиками и включения в комплексное лечение энтеросорбирующих лекарственных средств.
Актуальность
Атопический дерматит (АД) – мультифакторное генетически детерминированное воспалительное заболевание кожи, характеризующееся зудом, хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов поражения [1].
АД – одно из наиболее распространенных заболеваний (от 20 до 40% в структуре кожных заболеваний), встречающееся во всех странах, у лиц обоего пола и в разных возрастных группах. Распространенность АД среди детского населения составляет до 20%, среди взрослого населения – 2–8% [2].
Лечение и профилактика обострений АД представляет собой мультидисциплинарную проблему, требующую внимания педиатров, аллергологов, пульмонологов, клинических иммунологов, гастроэнтерологов. АД может быть ассоциирован с респираторной аллергией – риск ее развития, по разным данным, составляет от 30 до 80%. При этом риск развития аллергической реакции и бронхиальной астмы существенно выше у детей с пищевой аллергией [1].
К настоящему времени убедительно показано, что в основе патогенеза АД лежит взаимодействие генетических и экзогенных факторов [3, 4]. К генетическим факторам развития АД относят наличие мутации гена филаггрина, приводящей к нарушению функции эпидермального барьера [5], а также семейный анамнез аллергических заболеваний. Доказана роль аллергии к клещам домашней пыли, энтеротоксинам золотистого стафилококка, плесневым грибам, а также IgE-аутореактивности в механизмах развития заболевания [6]. На основании молекулярных механизмов, лежащих в основе клинических фенотипов АД, многие исследователи предлагают классификации эндотипов заболевания, что дает возможность применять индивидуальный подход к терапии пациентов с АД [7–9].
Во многом развитие и тяжесть течения АД определяют экзогенные ксенобиотики (чужеродные вещества, имеющие токсичные свойства) [10–12] (рисунок). Отмечено, что жители мегаполисов чаще страдают аллергическими заболеваниями и причиной этого может быть значительное загрязнение воздуха промышленными выбросами, бытовой химией и т.п. [13]. В то же время механизм этого явления до конца не раскрыт; имеется гипотеза развития АД как результата активации некоторыми компонентами ксенобиотиков так называемых медиаторов токсичности – арил-гидрокарбоновых рецепторов (АГР, AhR), что приводит к гипериннервации эпидермиса и, следовательно, к повышенной чувствительности кожи и воспалению [14].
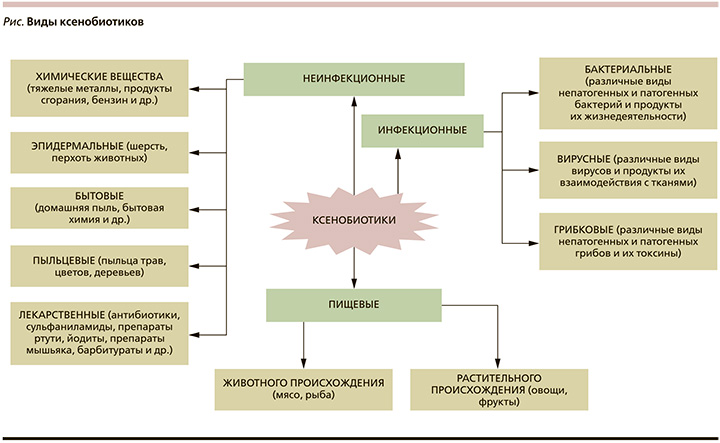
Защитными механизмами от воздействия экзогенных и эндогенных ксенобиотиков являются механизмы биотрансформации, реализуемые в организме посредством двух функционально сопряженных фаз [15]. В течение первой, несинтетической фазы происходит окисление, восстановление или гидролиз ксенобиотиков [16, 17]. Во вторую фазу биотрансформации метаболиты подвергаются дальнейшей детоксикации в клетках печени, почек, кожи, стенке кишечника и в других органах с последующим выведением из организма.
Ключевыми ферментами второй фазы биотрансформации ксенобиотиков в организме человека являются глутатион S‑трансферазы (GST) – мультигенное семейство ферментов, определяющее детоксикацию различных химических соединений путем конъюгации с глутатионом [18]. Известно, что цитоплазматические GST классов М1 и Т1 участвуют в механизмах возникновения и развития аллергических реакций, в т.ч. АД [19, 20] и их полиморфная экспрессия может предопределять различные клинические варианты течения заболевания, что достаточно хорошо изучено у детей [13, 21–23], однако у взрослых пациентов с АД исследовано мало.
Роль гена GSTP1, экспрессия которого превалирует в клетках кожи и плаценты, в патогенезе АД исследована мало, хотя известно, что GSTP1 играет важную роль в механизмах детоксикации [24].
Очевидно, что раннее определение врожденных дефектов детоксикации ксенобиотиков в организме больного АД поможет составить более эффективный лечебный комплекс и, что особенно важно, сформулировать индивидуальную программу профилактики обострений АД.
Цель исследования: определить возможность использования молекулярно-генетического тестирования для прогнозирования развития обострений АД и персонализации их профилактики.
Методы
Всего в исследование включены 52 пациента с АД легкого (n=23) и среднетяжелого (n=29) течения, среди которых было 28 женщин и 24 мужчины в возрасте от 15 до 44 лет.
У обследованных пациентов были диагностированы эритематозно-сквамозная форма АД, в т.ч. с очагами лихенификации, а также лихеноидная форма АД. У 23 (44,2%) пациентов высыпания были скудными и ограничивались преимущественно областями кистей и лица, однако кожный процесс у данных пациентов демонстрировал тенденцию к частому рецидивированию – не реже одного раза в один-два месяца. Частые обострения кожного процесса как основную жалобу отмечали 48 (92,3%) человек в группе исследования.
Пациентам исследуемой группы проводилось молекулярно-генетическое тестирование – определение полиморфизма генов GSTM1, GSTT1 и GSTP1 методом ПЦР.
Для этого сначала проводилось выделение ДНК и...












