Урология №6 / 2014
Опыт лечения аутоиммунного мужского бесплодия у пациентов с хроническим простатитом категории 4
Кафедра факультетской хирургии и урологии ГБОУ ВПО «Ивановская государственная медицинская академия» Минздрава Российской Федерации (зав. каф. – д.м.н., проф. А. И. Стрельников)
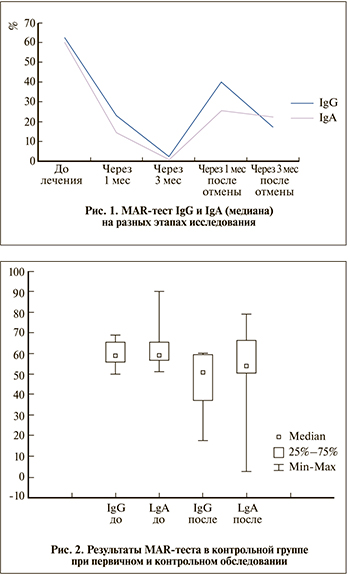
Назначение Лонгидазы по 3000 МЕ внутримышечно два раза в неделю спустя 1 мес лечения приводит к статистически значимому снижению уровня антиспермальных антител (АСАТ) на поверхности сперматозоидов до 23% (7–48%) для MARIgG и до 14,5% (3–34%) для MARIgA. Однако максимальное снижение содержания АСАТ наблюдалось к третьему месяцу лечения, в среднем MARIgG составил 2% (1–26,5%), а MARIgA – 1% (0–11,5%). Только у 1 (1,67%) пациента не произошло снижения АСАТ менее 50%. При контрольном обследовании через три месяца после отмены лонгидазы только у 17 (28,33%) мужчин отмечено повышение АСАТ IgG и(или) IgA более 50%. В основной группе за время наблюдения у 6 (10%) пар наступила спонтанная беременность, а 3 (5%) удачно выполнено ЭКО. Таким образом, считаем необходимым назначение лонгидазы пациентам с хроническим простатитом категории 4 и повышенным уровнем антиспермальных антител на сперматозоидах, готовящимся к вспомогательным репродуктивным технологиям или при подготовке к естественной беременности, в качестве высокоэффективного патогенетического средства для лечения аутоиммунного бесплодия.
Введение. По данным Европейской ассоциации урологов около 15% пар в течение года не достигают беременности, из них около 5% остаются бездетными, несмотря на лечение [1]. В 3,1–40,0% случаев нарушения мужской репродуктивной функции вызваны аутоиммунными реакциями против сперматозоидов, при которых происходит образование антиспермальных антител (АСАТ) [2–6]. В случае, когда все сперматозоиды покрыты АСАТ, вероятность зачатия снижается в 6,5 раза [7]. Впервые антигенные свойства спермы выявил И. И. Мечников в конце XIX в. [8]. Считается, что АСАТ слабо влияют на качественные показатели спермы [9, 10], но есть убедительные данные, согласно которым у больных с аутоиммунным бесплодием часто встречается астенозооспермия [11]. Необходимо отметить, что четкой корреляции между повышением количества сперматозоидов с АСАТ и такими показателями спермы, как подвижность и количество сперматозоидов, не выявлено [9], при том что при нормозоо- спермии нередко выявляется более 50% подвижных сперматозоидов, покрытых АСАТ [5, 7].
 По данным литературы, более десяти факторов могут стать причиной развития антиспермального иммунитета. Наиболее частые из них — травма и перекрут яичка, орхоэпидидимит, варикоцеле, эпидемический паротит, осложненный орхитом, врожденная или приобретенная обструкция семявыносящих путей, крипторхизм и рак яичка [3, 10, 13–19]. Можно считать доказанной роль Mycoplasma, Ureaplasma, Chlamydia в развитии аутоиммунного мужского бесплодия [4, 6, 7, 10, 20]. Имеется сообщение о влиянии вируса папилломы человека на образование АСАТ [11]. По некоторым данным, не вызывает образования АСАТ такие заболевания, как рак и доброкачественная гиперплазия предстательной железы [21]. До сих пор считается спорной связь между образованием АСАТ и другими неспецифическими воспалительными заболеваниями репродуктивного тракта [22], однако доказана молекулярная мимикрия между антигенами сперматозоидов и антигенами таких микроорганизмов, как St. aureus, E. coli, P. aeruginosa, P. mirabilis [23]. По мнению некоторых авторов, аутоиммунные реакции против сперматозоидов не характерны для бактериального хронического простатита, но способность некоторых микроорганизмов прикрепляться к мембране мужских гамет может обусловить образование АСАТ [4]. Нарушение целостности структурных компонентов гематотестикулярного барьера, обеспечивающего иммунологическую привилегированность тестикулярной ткани, является одним из основных механизмов развития аутоиммунных реакций против собственных сперматозоидов. В результате этого антигенпредставляющие клетки получают доступ к аутоантигенам развивающихся сперматогенных клеток, инициируя иммунный ответ [4, 6, 24, 25].
По данным литературы, более десяти факторов могут стать причиной развития антиспермального иммунитета. Наиболее частые из них — травма и перекрут яичка, орхоэпидидимит, варикоцеле, эпидемический паротит, осложненный орхитом, врожденная или приобретенная обструкция семявыносящих путей, крипторхизм и рак яичка [3, 10, 13–19]. Можно считать доказанной роль Mycoplasma, Ureaplasma, Chlamydia в развитии аутоиммунного мужского бесплодия [4, 6, 7, 10, 20]. Имеется сообщение о влиянии вируса папилломы человека на образование АСАТ [11]. По некоторым данным, не вызывает образования АСАТ такие заболевания, как рак и доброкачественная гиперплазия предстательной железы [21]. До сих пор считается спорной связь между образованием АСАТ и другими неспецифическими воспалительными заболеваниями репродуктивного тракта [22], однако доказана молекулярная мимикрия между антигенами сперматозоидов и антигенами таких микроорганизмов, как St. aureus, E. coli, P. aeruginosa, P. mirabilis [23]. По мнению некоторых авторов, аутоиммунные реакции против сперматозоидов не характерны для бактериального хронического простатита, но способность некоторых микроорганизмов прикрепляться к мембране мужских гамет может обусловить образование АСАТ [4]. Нарушение целостности структурных компонентов гематотестикулярного барьера, обеспечивающего иммунологическую привилегированность тестикулярной ткани, является одним из основных механизмов развития аутоиммунных реакций против собственных сперматозоидов. В результате этого антигенпредставляющие клетки получают доступ к аутоантигенам развивающихся сперматогенных клеток, инициируя иммунный ответ [4, 6, 24, 25].
Антиспермальные антитела нарушают функциональную целостность мембраны сперматозоидов, проницаемость мембраны для воды и как следствие – для кальция, препятствуют продвижению сперматозоидов и их проникновению через цервикальную слизь, блокируют рецепторные участки на головке сперматозоида, ответственные за связывание с блестящей оболочкой, нарушают акросомальную реакцию, оказывают повреждающее действие на предстательную железу [10, 15, 26, 27].
 В настоящее время с целью клинической диагно-
стики аутоиммунного мужского бесплодия предпочтение отдается методам определения АСАТ, адгезированных на поверхности сперматозоидов [4, 28, 29], поэтому одним из наиболее чувствительных и информативных в прогнозе фертильности считается mixed agglutination reaction (MAR)-test [30, 31].
В настоящее время с целью клинической диагно-
стики аутоиммунного мужского бесплодия предпочтение отдается методам определения АСАТ, адгезированных на поверхности сперматозоидов [4, 28, 29], поэтому одним из наиболее чувствительных и информативных в прогнозе фертильности считается mixed agglutination reaction (MAR)-test [30, 31].
Согласно данным ВОЗ (2010) и приказу Министер- ства здравоохранения РФ № 107н «...












