Терапия №4 / 2015
Особенности клиники и лечения несахарного диабета
ГБОУ ДПО «Российская медицинская академия последипломного образования», кафедра эндокринологии и диабетологии, г. Москва
В статье представлены современные данные об этиологии, патогенезе, клинике, диагностике и лечении несахарного диабета (НСД). Рассмотрена классификация НСД, подробно описаны методы диагностики, позволяющие установить дифференциальный диагноз. Приведены клинические примеры генетических форм центрального НСД, описан DIDMOAD-синдром, наследуемый по аутосомно-рецессивному типу. Подчеркивается необходимость этиологического лечения НСД, при этом отмечена важность подбора заместительной терапии препаратами вазопрессина. Описаны особенности подбора дозы десмопрессина и лабораторные методы оценки эффективности проводимой терапии. Сделан вывод о том, что гипоталамические формы НСД наиболее хорошо поддаются терапии, в отличие от НСД психогенного и нефрогенного генеза.
«Синдром обильной мочи» был известен с глубокой древности и объединял как сахарный, так и несахарный диабет. Впервые по вкусу мочи разделил диабет на сахарный (diabetes mellitus) и несахарный, безвкусный (diabetes insipidus) Томас Уиллис в 1674 г. В 1953–1954 гг. Винсент де Виньо установил структуру антидиуретического гормона (АДГ, вазопрессина), за что ему была присуждена Нобелевская премия, а в 1956 г. был осуществлен синтез вазопрессина и окситоцина.
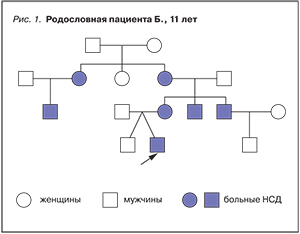
Несахарный диабет (НСД) является относительно редким эндокринным заболеванием, его распространенность в популяции не превышает 0,004–0,01%. Вновь выявленные случаи составляют примерно 1:1000000 населения в год. В России число больных НСД достигает примерно 21,5 тыс. человек [1, 2].
НСД обусловлен поражением гипоталамо-гипофизарной области со снижением секреции АДГ или нечувствительностью к нему почечных канальцев и характеризуется полидипсией и полиурией с низкой плотностью мочи (1001–1005 г/л). Физиологическая роль АДГ заключается в регуляции водно-электролитного баланса организма, задержке воды, поддержании осмолярности жидких сред организма, объема крови и артериального давления (АД). Кроме того, он участвует в секреции кортикотропин-релизинг-гормона, механизмах памяти и реакции на стресс. Снижение секреции АДГ проявляется в виде клинического синдрома НСД.
 По химической структуре АДГ представляет собой нанопептид с молекулярной массой 1080 дальтон, содержит 9 аминокислот и состоит из шестичленного кольца, замкнутого дисульфидным мостиком, и трехчленной концевой части, в которой находится аргинин, поэтому химическое название АДГ человека – аргинин-вазопрессин. Вазопрессин является гормоном головного мозга и синтезируется в нейросекреторных ядрах переднего гипоталамуса – супраоптическом и паравентрикулярном. В составе нейросекреторных гранул АДГ продвигается по аксону в заднюю долю гипофиза со скоростью примерно 3 мм/ч. Секреция АДГ происходит в ответ на сгущение крови и изменение АД при перемене положения тела, при этом гланулы разделяются на АДГ и нейрофизин-II. При повреждении ножки гипофиза (травма, опухоль, кровоизлияние, операция, роды) нарушается секреция АДГ. Нейросекреторные гранулы начинают накапливаться выше места повреждения, и со временем здесь может произойти перестройка сосудов, восстановление секреции гормона в кровь и спонтанное излечение от НСД.
По химической структуре АДГ представляет собой нанопептид с молекулярной массой 1080 дальтон, содержит 9 аминокислот и состоит из шестичленного кольца, замкнутого дисульфидным мостиком, и трехчленной концевой части, в которой находится аргинин, поэтому химическое название АДГ человека – аргинин-вазопрессин. Вазопрессин является гормоном головного мозга и синтезируется в нейросекреторных ядрах переднего гипоталамуса – супраоптическом и паравентрикулярном. В составе нейросекреторных гранул АДГ продвигается по аксону в заднюю долю гипофиза со скоростью примерно 3 мм/ч. Секреция АДГ происходит в ответ на сгущение крови и изменение АД при перемене положения тела, при этом гланулы разделяются на АДГ и нейрофизин-II. При повреждении ножки гипофиза (травма, опухоль, кровоизлияние, операция, роды) нарушается секреция АДГ. Нейросекреторные гранулы начинают накапливаться выше места повреждения, и со временем здесь может произойти перестройка сосудов, восстановление секреции гормона в кровь и спонтанное излечение от НСД.
Основным механизмом регуляции секреции АДГ является изменение осмолярности (вязкости) плазмы крови. У каждого человека имеется свой индивидуальный осмотический порог, при котором начинается секреция АДГ. Он стабильный на протяжении жизни и контролируется с исключительной точностью. Например, он может быть равен 287,3 мОсм/кг [2]. Для физиологической стимуляции секреции АДГ важное значение имеют объем плазмы, концентрация ионов натрия в плазме и спинномозговой жидкости и уровень АД. Уменьшение объема крови, повышение концентрации ионов натрия или снижение АД стимулируют секрецию АДГ, тогда как увеличение объема плазмы, снижение концентрации ионов натрия и повышение АД тормозят освобождение гормона. Такие физиологические стимулы, как боль, стресс, сон, физическая нагрузка, повышение температуры окружающей среды, никотин стимулируют секрецию АДГ и уменьшают диурез, тогда как воздействие холода, алкоголь, избыточное потребление воды снижают секрецию АДГ и увеличивают диурез.
МЕХАНИЗМ ДЕЙСТВИЯ АНТИДИУРЕТИЧЕСКОГО ГОРМОНА
В основе механизма действия АДГ лежит стимуляция обратного всасывания воды в дистальных канальцах и собирательных трубочках почечного нефрона. Первичная моча имеет осмолярность, аналогичную плазме. Конечная концентрация мочи зависит от наличия или отсутствия АДГ. В присутствии гормона увеличивается обратное всасывание воды, и моча выделяется концентрированной. При дефиците АДГ выделяется много разбавленной мочи. При нормальной секреции АДГ осмолярность мочи всегда выше 300 мОсм/ кг и может увеличиваться до 1200 мОсм/кг и более, при его дефиците – осмолярность мочи обычно ниже 200 мОсм/ кг. При полном отсутствии секреции АДГ и удельной плотности мочи 1001 г/л осмолярность мочи составляет 33,3 мОсм/кг. Для определения осмолярности мочи необходимо две последние цифры удельной плотности мочи умножить на коэффициент, равный 33,3 [3].

Действие АДГ на клеточном уровне реализуется через осмо- и барорецепторы, причем каждая из этих систем действует самостоятельно. Осморегуляция осуществляется в очень узких пределах. Изменение осмолярности плазмы всего на 1% вызывает корригирующую секрецию АДГ, тогда как в отношении объема крови секреция АДГ возникает при уменьшении объема крови на 7–15%, однако при быстром уменьшении объема крови (например, при кровопотере) объемная реакция преобладает над осмолярной. АДГ участвует в поддержании АД при изменении положения тела, сокращая сосуды при вставании и не давая развиться ортостатическому коллапсу.
Ме...












