Акушерство и Гинекология №3 / 2022
Особенности профиля экспрессии митохондриальной ДНК в среде культивирования эмбрионов в программах вспомогательных репродуктивных технологий
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации, Москва, Россия
Цель: Изучить возможность использования количественной оценки копийности гена MT-ND1 в отра-ботанной культуральной среде как маркера успешной имплантации и качества эмбрионов.
Материалы и методы: Проанализирован уровень копийности гена MT-ND1 в отработанной культу-ральной среде в зависимости от качества эмбрионов, возраста матери и исходов переноса эмбриона в полость матки.
Результаты: Всего получено 142 эмбриона: 102 бластоцисты, а также 40 эмбрионов, остановившихся в развитии. Распределение копий мтДНК в указанных группах эмбрионов не имело статистически значимой разницы (p=0,919). В зависимости от морфологической оценки все бластоцисты разделили на 2 группы: 1-я группа (отличные и хорошие) — 60 эмбрионов, 2-я группа (средние и плохие) — 42 эмбриона. Распределение копий мтДНК в указанных группах не достигло статистически значимых различий (p=0,082). Все бластоцисты разделили на группы в зависимости от возраста пациенток: 1-я группа (до 35 лет) — 63 эмбриона, 2-я группа (после 35 лет) — 39 эмбрионов. Количество копий мтДНК было статистически значимо выше в группе пациенток в возрасте до 35 лет (p=0,001). Перенос эмбрионов был произведен у 24 пациенток. В зависимости от исхода переноса эмбрионов пациентки были разделены на группы: 1-я группа (отрицательный результат) — 17 пациенток, 2-я группа (клиническая беременность) — 7 пациенток. Распределение копий мтДНК в указанных группах не имело значимой разницы (p=0,234).
Заключение: Культуральная среда является источником мтДНК, которая может быть детектирована и анализирована методом количественной ПЦР. Уровень мтДНК в отработанной культуральной среде — перспективный дополнительный маркер для выбора эмбриона, переносимого в полость матки.
Главной задачей лечения бесплодия методами вспомогательных репродуктивных технологий (ВРТ) является помощь в наступлении беременности и рождении здорового ребенка. Повышение частоты имплантации и продолжающейся беременности достигается несколькими путями, основной из которых - отбор эмбриона для переноса в полость матки с высоким потенциалом к имплантации и дальнейшему развитию. Оценка эмбрионов в настоящее время чаще всего проводится на основании морфологических критериев, а также результатов преимплантационного генетического тестирования на анеуплоидии (ПГТ-А). По данным современных исследований, проведение ПГТ-А увеличивает частоту имплантации на перенос, снижает риск потери беременности в I триместре и сокращает время до наступления беременности [1, 2]. При этом проведение ПГТ-А имеет и свои недостатки, главным из которых является инвазивность процедуры. Необходимо выполнение биопсии клеток эмбриона, что может вызывать снижение его имплантационных возможностей.
В настоящее время чрезвычайно актуален поиск методов неинвазивной диагностики преимплантационных эмбрионов человека в программах лечения бесплодия методами ВРТ. В качестве источника ДНК эмбриона исследователи все чаще рассматривают отработанную культуральную среду (собранную после культивирования эмбриона). Показано, что использованная культуральная среда содержит внеклеточную ДНК эмбриона и митохондриальную ДНК (мтДНК), анализ которых имеет высокий потенциал для оценки и отбора эмбрионов, наиболее перспективных для переноса в полость матки.
В ряде научных работ уже прослежено возможное эффективное проведение неинвазивного ПГТ-А с оценкой свободной ДНК эмбриона, детектированной в использованной культуральной среде [3—5]. Оценка мтДНК, выделенной из питательной среды после культивирования, в комбинации с морфологическими методами оценки качества эмбрионов также перспективна для выбора эмбрионов с большим потенциалом к дальнейшему развитию [6—12]. Результаты исследований предполагают возможность проведения неинвазивной оценки содержания эмбриональной мтДНК в культуральной среде. В сочетании с морфологией эмбриона они могут помочь клиническим эмбриологам ранжировать эмбрионы с целью селективного переноса эмбриона, имеющего больший потенциал развития.
Цель исследования: изучить возможность использования количественной оценки копийности гена MT-ND1 в отработанной культуральной среде как маркера успешной имплантации и качества эмбрионов.
Материалы и методы
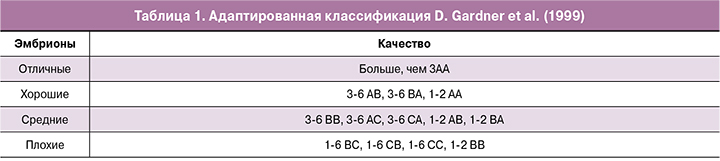
Исследование проведено на базе отделения вспомогательных технологий в лечении бесплодия им проф. Б.В. Леонова ФГБУ «НМИЦ акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России. Проанализировано 173 образца культуральной среды: 142 образца, содержащих эмбрионы, 31 образец в качестве отрицательного контроля без эмбриона. В исследование включены 53 супружеские пары. У всех пациентов овариальная стимуляция проходила в рамках стандартных протоколов. Через 36 ч после введения триггера производился забор ооцитов с помощью трансвагинальной пункции фолликулов. Оплодотворение ооцитов проводилось методом ИКСИ, после чего оплодотворенные клетки переносили в культуральную среду CSCM (Irvine Sc., США). Все этапы культивирования выполняли в мультигазовых инкубаторах СООК (Ирландия) в каплях по 25 мкл под маслом (Irvine Sc., США). Среду CSCM (Irvine Sc., США) не меняли в течение 5—6 суток культивирования. На 5-е или 6-е сутки после оплодотворения проводилась морфологическая оценка бластоцист согласно классификации D. Gardner et al. (1999) и методическим рекомендациям РАРЧ по оценке ооцитов и эмбрионов в лаборатории ВРТ (2021) (табл. 1).
Всего оценили 142 эмбриона: 102 бластоцисты и 40 эмбрионов, остановившихся на стадии дробления или дегенеративных. В зависимости от морфологической оценки, все бластоцисты разделили на 2 группы: 1-я группа (отличные и хорошие) — 60 эмбрионов, 2-я группа (средние и плохие) — 42 эмбриона. На основании морфологической оценки отобраны эмбрионы, наиболее перспективные для переноса в полость матки. Выполнено 24 селективных переноса эмбрионов 5—6 суток в полость матки в нативном цикле. Перенос эмбрионов в полость матки осуществлялся с помощью мягкого катетера Wallace (Германия) или Cook (Австралия). Перенос эмбрионов был произведен у 24 пациенток. В зависимости от исхода переноса пациенты разделены на группы: 1-я группа (отрицательный результат) — 17 случаев, 2-я группа (клиническая беременность) — 7 случаев.
Кроме того, все бластоцисты разделили на группы в зависимости от возраста пациенток: 1-я группа (до 35 лет) - 63 эмбриона, 2-я группа (после 35 лет) - 39 эмбрионов.
Отрицательным контролем служили капли куль-туральной среды (31 образец), находящиеся в тех же условиях культивирования, но не содержащие эмбрионы. После завершения культивирования эмбрионов все образцы культуральной среды (содержащие и не содержащие эмбрионы) ...












