Клиническая Нефрология №4 / 2015
Отдаленные результаты применения сочетанной плазмофильтрации и адсорбции для коррекции ишемического и реперфузионного повреждения почечного трансплантата
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского»
Трансплантация почки неизбежно сопровождается ишемическим и реперфузионным повреждением трансплантата. Этот синдром представляет собой сложный, многокомпонентный процесс, в патогенезе которого одну из важнейших ролей играют медиаторы воспаления – цитокины. Одной из методик, позволяющих эффективно снижать их концентрацию, является сочетанная плазмофильтрация и адсорбция (СПФА). Первые результаты исследования свидетельствуют, что снижение концентрации циркулирующих медиаторов обладает протективным эффектом. Мы оценили долгосрочные результаты применения этого метода.
Цель исследования. Оценить отдаленные результаты применения сочетанной плазмофильтрации и адсорбции в раннем послеоперационном периоде для снижения тяжести ишемического и реперфузионного повреждения почечного трансплантата.
Пациенты и метод исследования. Отдаленные результаты трансплантации почки у 33 пар реципиентов. Пациенты разделены на две группы: 33 реципиентам основной группы проводили СПФА в раннем послеоперационном периоде, 33 реципиентам группы сравнения, получавших парные почки, СПФА не проводили. Исследовали концентрацию креатинина и мочевины в крови, истинную скорость клубочковой фильтрации, уровень суточной протеинурии через 3, 6 и 12 месяцев после трансплантации почки. Также проводили протокольные биопсии через год после АТП и биопсии при появлении дисфункции трансплантата.
Результаты исследования. При анализе отдаленных результатов отмечено, что у больных, получивших СПФА в раннем послеоперационном периоде, через год после трансплантации отмечено меньшее количество эпизодов острого отторжения трансплантата и меньшая тяжесть хронической трансплантационной нефропатии. Функция трансплантата основной группы была лучше: ниже уровни азотемии и суточной протеинурии, выше СКФ. Различия между группами нарастали по мере увеличения срока послеоперационного периода.
Выводы. Таким образом, в результате применения СПФА в раннем послеоперационном периоде можно ожидать улучшения функции в долгосрочной перспективе и улучшения прогноза выживаемости трансплантата.
Введение
В патогенезе ишемического/реперфузионного повреждения (ИРП) большое значение имеют не только повреждение клеток и их прямые межклеточные взаимодействия, но и циркулирующие факторы, поскольку после включения в кровоток трансплантированной почки происходит поступление в сосудистое русло реципиента массы токсинов, медиаторов и продуктов анаэробного метаболизма [1–5].
Реакции, происходящие в ПАТ, подвергнутому реперфузии, опосредуются различными видами медиаторов. Из них основными регуляторами воспаления, экспрессии молекул адгезии и активации лейкоцитов служат цитокины [6–8].
Цитокины – пептиды с небольшим молекулярным весом, являются регуляторными белками. Ишемия почки приводит к активации транскрипционных факторов – NF-κβ, белка теплового шока HSP, гипоксия-индуцируемого фактора (HIF). Транскрипционный ответ на острую ишемию приводит к выделению провоспалительных цитокинов – ИЛ-1, -2, -6, -8, ФНОα, γ-интерферона. Цитокины играют важную роль как в местных, таких и в системных процессах у донора и реципиента. Известно, что селективное блокирование или удаление цитокинов способно ослабить тяжесть ИРП [8].
М.В. Гринев и соавт. рассматривают синдром ишемии-реперфузии как неспецифический процесс и отмечают схожесть патогенеза ИРП при сепсисе, травматическом и ожоговом шоке, остром панкреатите, синдроме ишемии-реперфузии при трансплантации почек, ишемии нижних конечностей при поражении сосудов, кишечной непроходимости. При этом одну из основных ролей в развитии этих состояний авторы отводят циркулирующим цитокинам [6].
Подходы к борьбе с ИРП при АТТП можно разделить на три основных направления. Первое – борьба с неспецифическими факторами: уменьшение продолжительности холодовой и тепловой ишемии, улучшение контроля за состоянием донора на предагональном этапе, совершенствование способов консервирования трансплантата и др. Второе – применение различных препаратов для коррекции метаболических нарушений в ПАТ и его фармакопротекции для воздействия на отдельные звенья патогенеза реперфузионного повреждения. Однако, несмотря на множество предложенных методик, возможности как первого, так и второго названных подходов на сегодняшний день очень ограничены, что диктует необходимость совершенствования методов борьбы с ИРП [9–11].
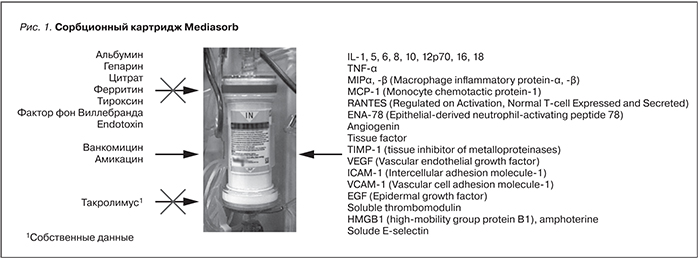
Третий подход к лечению ИРП – применение методов экстракорпоральной гемокоррекции. Весьма перспективным, однако, недостаточно изученным является метод селективной сорбции цитокинов в комбинации с гемофильтрацией [13, 14]. В основе этой методики лежит процедура сочетанной плазмофильтрации и адсорбции (СПФА) в специальном картридже – Mediasorb. Мы используем этот метод в комбинации с гемофильтрацией, в т.ч. и для снижения тяжести ишемического и реперфузионного повреждения. Первые результаты свидетельствуют в пользу эффективности этого метода. Однако отдаленные результаты пока не изучены.
Цель исследования: оценить отдаленные результаты применения сочетанной плазмофильтрации и адсорбции в раннем послеоперационном периоде для снижения тяжести ишемического и реперфузионного повреждения почечного трансплантата.
Материал и методы
Проведено открытое рандомизированное исследование, в которое включили 33 пары реципиентов. Пациенты, которым проведена СПФА, составили основную гру...












