Акушерство и Гинекология №5 / 2015
Персонализированный подход к назначению мифепристона пациенткам с миомой матки
1 ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, Москва; 2 ГБУЗ МО Московский областной научно-исследовательский институт акушерства и гинекологии, Россия; 3 Национальный медико-хирургический центр им. Н.И. Пирогова, кафедра женских болезней и репродуктивного здоровья, Москва, Россия
Цель исследования. Изучить экспрессию генов стероидных рецепторов (mER, PR-A, GR, AR) в мононуклеарах крови пациенток с миомой матки в зависимости от эффективности терапии мифепристоном.
Материал и методы. В исследование вошли 50 пациенток, размеры миомы менее 12 недель беременности (интерстициальная, интерстициально-субсерозная локализация узлов). Мифепристон (гинестрил, «Stada») 50 мг перорально ежедневно 3 месяца. Уровень экспрессии генов рецепторов в МНФК пациенток определяли методом RT-PCR.
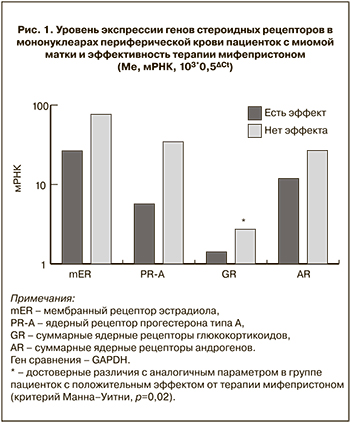
Результаты. Повышенная экспрессия генов ядерных рецепторов глюкокортикоидов в 5 раз (р=0,02) у пациенток с отсутствием эффекта мифепристона на размеры миомы.
Заключение. Рецепторный профиль МНФК может служить косвенным прогностическим признаком эффективности и целесообразности применения мифепристона в терапии пациенток с миомой матки.
Актуальность проблемы лечения миомы матки обусловлена широкой ее распространенностью, значительным влиянием на качество жизни пациенток, увеличением частоты появления с возрастом и очевидным «омоложением» заболевания. Средний возраст выявления миомы матки составляет 32,8±0,47 года, а показания к хирургическому лечению (часто к радикальному) появляются примерно к 45 годам [1].
Изменение социальных условий существования женщины, которая планирует беременность в гораздо более позднем возрасте, требует заменить привычное «наблюдение» активными действиями, позволяющими затормозить заболевание.
В настоящее время обозначился новый тренд в органосохраняющих методах ведения женщин с миомой матки – в связи с доказанной ролью прогестерона в контроле пролиферации клеток миомы на ведущее место в фармакотерапии выходят селективные модуляторы прогестероновых рецепторов (СМПР). Доступными селективными модуляторами рецепторов прогестерона являются мифепристон, улипристал, азоприснил [2–4].
С помощью данной патогенетической терапии возможно не только уменьшать проявление основных симптомов заболевания, но и отсрочить оперативное лечение (при миоме матки, не превосходящей размеры 12-недельной беременности).
Из всего спектра медикаментозных средств, применяемых для лечения миомы матки, СМРП отличаются лучшим профилем безопасности и сравнимой или более высокой эффективностью [5]. Как и любая лекарственная терапия, применение СМРП при миоме не демонстрирует абсолютной эффективности, однако существуют теоретические предпосылки ее повышения. Резервом повышения эффективности применения СМРП в лечении миомы матки является персонализация их назначения, для чего требуется выявление маркера эффективности, который можно будет использовать в индивидуальном подборе терапии конкретной пациентке. Для этого необходим анализ данных динамического исследования ключевых молекулярно-фармакологических и биохимических параметров женщин с миомой в зависимости от успеха антигормонального лечения.
В качестве объекта исследования нами выбраны мононуклеарные клетки периферической крови (МНФК), которые в последнее время используются для мониторинга лечения гормонозависимых заболеваний репродуктивной системы женщины [6]. МНФК экспрессируют практически все рецепторы половых стероидных гормонов, что подтверждает эндокринный контроль функции иммунокомпетентных клеток [7]. Ранее нами показано, что в МНФК преобладает экспрессия следующих стероидных рецепторов: мембранный рецептор эстрадиола (mER), ядерный рецептор прогестерона типа А (PR-A), ядерные глюкокортикоидные (GR) и андрогеновые (AR) рецепторы [8].

Учитывая роль половых гормонов в патогенезе миомы матки и наличие/функциональное значение рецепторов стероидов в иммунокомпетентных клетках, нами в качестве молекулярно-фармакологических кандидатов выбраны параметры стероидно-рецепторного транскриптома клеток МНФ периферической крови пациенток с миомой матки до лечения мифепристоном.
Цель работы – изучить экспрессию генов рецепторов эстрадиола (mER), прогестерона (PR-A), глюкокортикоидов (GR), андрогенов (AR) в МНФК пациенток с миомой матки в зависимости от эффективности терапии мифепристоном.
Материал и методы исследования
 В исследование были включены 50 пациенток в возрасте от 18 до 45 лет с миомой матки, соответствующей по величине 6–12-недельной беременности с интерстициальной и интерстициально-субсерозной локализацией миоматозных...
В исследование были включены 50 пациенток в возрасте от 18 до 45 лет с миомой матки, соответствующей по величине 6–12-недельной беременности с интерстициальной и интерстициально-субсерозной локализацией миоматозных...












