Фарматека №17 (290) / 2014
Пертузумаб – новый взгляд на HER2-положительный метастатический рак молочной железы
(1) ФГБНУ РОНЦ им. Н.Н. Блохина, Москва; (2) ГБОУ ДПО РМАПО Минздрава России, Москва
С момента внедрения трастузумаба — моноклонального антитела против рецептора HER2 – в рутинную клиническую практику изменился взгляд на лечение данной подгруппы больных и на прогноз заболевания в целом: больные HER2-позитивными опухолями, ранее считавшимися наиболее неблагоприятными, в настоящее время имеют наилучший прогноз.
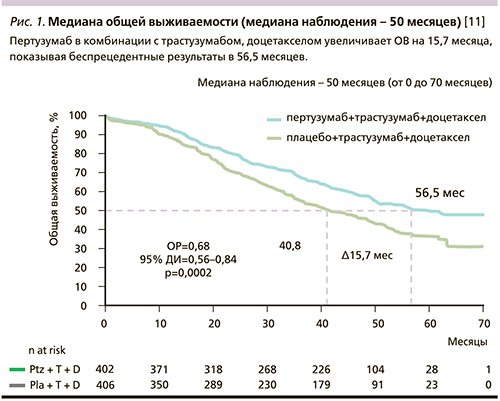
Однако очевиден тот факт, что не все пациенты с гиперэкспрессией HER2 отвечают на трастузумаб-содержащую терапию. Применение комбинации пертузумаба, трастазумаба и доцетаксела в I линии лечения метастатического рака молочной железы позволило значительно увеличить эффективность лечения. В исследовании CLEOPATRA получено беспрецедентное увеличение общей выживаемости больных, получивших в I линии лечения комбинацию пертузумаба, трастузумаба и доцетаксела, по сравнению с группой плацебо, трастузумаб, доцетаксел (56,5 против 40,8 месяца). Кроме того, применение пертузумаба в комбианции с трастузумабом и доцетакселом позволяет увеличивать время до выявления метастазов в головной мозг. Также в статье приводится описание клинического случая больной, получавшей лечение в рамках исследования более 60 месяцев.
Гиперэкспрессия HER2 встречается приблизительно в 20–25% случаев инвазивного рака молочной железы (РМЖ) и ассоциируется с неблагоприятным прогнозом. С момента внедрения трастузумаба — моноклонального антитела против рецептора HER2, в рутинную клиническую практику изменился взгляд на лечение данной подгруппы больных и на прогноз заболевания в целом. Больные с HER2-позитивными опухолями, ранее считавшимися наиболее неблагоприятными, в настоящее время имеют наилучший прогноз [1–3].
Однако очевиден тот факт, что не все пациенты с гиперэкспрессией HER2 отвечают на трастузумаб-содержащую терапию. Приблизительно 15% больных имеют прогрессирование на терапии с включением трастузумаба, что свидетельствует о наличии первичной или приобретенной резистентности к препарату [4]. На этом основаны дальнейшие поиски дополнительной терапии для включения в режимы лечения с лапатинибом, нератинибом, афатинибом, T-DM1 (трастузумаб мейтанзин) и пертузумабом.
Пертузумаб – гуманизированное моноклональное антитело, которое связывается с внеклеточным доменом II HER2-рецептора и препятствует димеризации HER-рецепторов.
Семейство рецепторов эпидермального фактора роста включает 4 рецептора: erbB1 (EGFR, HER1), erbB2 (HER2), erbB3 и erbB4, которые экспрессируются на подавляющем большинстве нормальных и опухолевых эпителиальных клеток. По своей структуре они относятся к трансмембранным тирозинкиназным рецепторам, состоящим из внеклеточного (экстрацеллюлярного) домена, трансмембранного домена, отвечающего за промежуточную передачу сигнала; внутриклеточного тирозинкиназного домена, запускающего каскад реакций, необходимых для конечной реализации действия рецептора. Внеклеточный домен дополнительно подразделяется на 4 части: домен I служит для связывания с лигандом, домен II – для димеризации с другими рецепторами семейства, домен IV – для связывания с трастузумабом.
Все рецепторы неактивны в виде мономеров, однако при связывании внеклеточного домена со специфическим лигандом происходит активация рецептора (образование гомо- и гетеродимеров). EGFR, ErbB3 и ErbB4 имеют установленные лиганды, воздействие которых приводит к димеризации рецепторов, необходимой для «запуска» тирозинкиназной эффекторной части. HER2 является единственным рецептором, которому для активации не требуется соединения с лигандом. При этом HER2 является предпочтительным партнером для димеризации благодаря открытой конформации рецептора. HER2-содержащие гетеродимеры имеют более высокую стабильность [5], из всех возможных гетеродимеров этого семейства наибольшей активностью обладает комплекс HER2:HER3. Предполагается, что именно димеризация (образование пар) рецепторов HER2 и HER3 является одной из ведущих причин развития лекарственной резистентности, т.к. ведет к повышению активности сигнальных путей PI3K и МАРК, ответственных за рост, пролиферацию и нарушение апоптоза опухолевой клетки. Блокируя образование HER2-содержащих димеров, пертузумаб угнетает многочисленные пути передачи сигнала, опосредованные HER-рецепторами (в первую очередь HER2:HER3). Пертузумаб и трастузумаб связываются с различными эпитопами HER2-рецептора, и их совместное использование благодаря комплементарным механизмам действия позволяет добиваться блокады большего количества сигнальных путей и как следствие – большей противоопухолевой эффективности.
В нескольких исследованиях I фазы изучали пертузумаб в монотерапии, в комбинации с различными режимами химиотерапии и с трастузумабом у больных метастатическим HER2-положительным РМЖ, резистентным к стандартным режимам лечения.
В результате проведенных исследований была показана хорошая переносимость пертузумаба, наиболее частые побочные эффекты не превышали 1–2-ю степени и включали астению, сыпь, диарею, тошноту, при этом максимально переносимая доза не была достигнута.
В ряде пилотных исследований II фазы было показано, что пертузумаб может быть эффективен и после неудачи терапии трастузумабом [6], однако наилучшие результаты были получены при комбинации этих двух моноклональных антител [7]. Из 66 включенных в исследование больных контроля болезни (полный+частичный регресс+стабилизация болезни>6 месяцев) удалось добиться в 50% случаев, причем длительной стабилизации – у 17 больных. Медиана времени до прогрессирования составила 5,5 месяца. Комбинация хорошо переносилась, не было отмечено случаев прекращения лечения из-за развития кардиальной токсичности.
На основании проведенных исследовании I–II фаз рекомендуемая доза пертузумаба составляет 840 мг – нагрузочная доза, далее 420 мг – каждые 3 недели.
Полученные результаты легли в основу рандомизированного исследования III фазы (CLEOPATRA) [8] по изучению эффективности комбинации пертузумаба и трастузумаба в I линии терапии метастатического HER2-положительного РМЖ.












