Акушерство и Гинекология №5 / 2017
Поиск маркеров персонального «окна имплантации» у женщин в программе экстракорпорального оплодотворения с помощью определения транскрипционного профиля генов
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова
Минздрава России, Москва
Цель исследования. Повышение эффективности определения функционального состояния эндометрия периода «окна имплантации» на основе интегральной оценки транскриптов генов как маркеров готовности эндометрия к имплантации эмбриона.
Материал и методы. В исследование включена 71 женщина без патологии эндометрия с реализованной репродуктивной функцией, из них 47 – с помощью программы ЭКО. В период предполагаемого «окна имплантации» выполнена пайпель-биопсия эндометрия в естественном цикле, проведено гистологическое исследование и определен транскрипционный профиль генов GPX3, PAEP, DPP4, TAGLN, HABP2, IMPA2, AQP3, HLA-DOB, MSX1, POSTN методом количественной обратной транскрипции и полимеразной цепной реакции в режиме реального времени.
Результаты. Установлены различия в уровне экспрессии мРНК всех исследованных генов в рецептивном эндометрии по сравнению с пререцептивным, что позволило классифицировать два функциональных состояния эндометрия. На основе интегральной оценки уровня экспрессии мРНК 4 генов PAEP, DPP4, MSX1 и HLA-DOB может быть определен рецептивный статус эндометрия. В 83% случаев получено соответствие результатам гистологического исследования стадии созревания эндометрия.
Заключение. Предложена модель определения персонального «окна имплантации», которая в дальнейшем может быть использована в программах вспомогательных репродуктивных технологий.
Функциональный слой эндометрия циклически претерпевает процессы регенерации, секреторной трансформации и отторжения в течение менструального цикла в ответ на воздействие стероидных гормонов. Конечная цель этих физиологических изменений состоит в обеспечении восприимчивого к имплантации эмбриона статуса эндометрия и синхронизации процессов созревания бластоцисты и тканей эндометрия. Имплантация бластоцисты осуществляется в строго определенный период «окна имплантации», соответствующий 7–8-му дню после пика лютеинизирующего гормона (ЛГ), у женщин с 28-дневным менструальным циклом обычно на 19–21-й день менструального цикла. Однако исследования последних лет продемонстрировали, что в связи с индивидуальными физиологическими особенностями организма женщин возможны сдвиги «окна имплантации», которые могут приводить к снижению эффективности программ вспомогательных репродуктивных технологий (ВРТ) [1–3].
Морфологические изменения эндометрия на протяжении менструального цикла описаны R.W. Noyes более 60 лет назад и широко используются до настоящего времени. Критерии R.W. Noyes, используемые для диагностики нарушений секреторной трансформации эндометрия, основаны на таких морфологических параметрах, как наличие вакуолей, отек стромы, секреция желез и др. в соответствии с днями менструального цикла [4, 5].
Однако их точность поставлена под сомнение в рандомизированных исследованиях [1, 2]. Поэтому в настоящее время определение состоятельности секреторной трансформации эндометрия с помощью гистологического исследования структуры функционального слоя эндометрия является недостаточным и должно дополняться новыми высокоинформативными методами оценки рецептивности эндометрия.
В последние годы были проведены исследования глобальных транскриптомных профилей генов в различных условиях, оказывающих влияние на качественное состояние эндометрия. Исследования с применением микроматричного анализа продемонстрировали несостоятельность концепции универсального соответствия стадии «окна имплантации» 19–21-му дню менструального цикла. У каждой четвертой пациентки с неудачными попытками экстракорпорального оплодотворения (ЭКО) происходит смещение окна имплантации на 2–3 дня, что имеет фатальные последствия для реализации программы ВРТ [3].
Основным результатом проведенных исследований глобальных транскрипционных профилей генов стала идентификация наиболее информативных маркеров стадии «окна имплантации», часть из которых уже вошла в список «золотого стандарта» рецептивности эндометрия [6, 7].
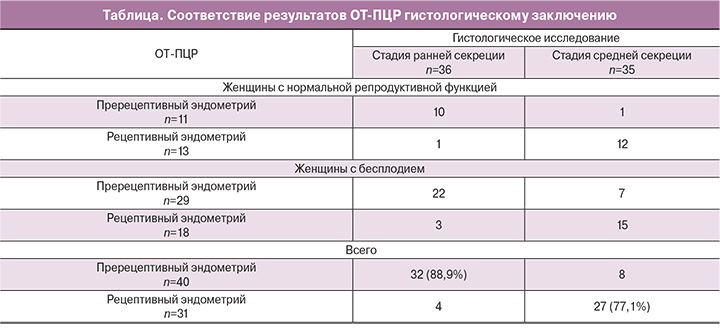
На практике альтернативой дорогому, трудоемкому и дающему избыточную информацию методу микроматричного анализа может быть метод количественной обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР). Для определения персонального «окна имплантации» у женщин с неудачными попытками в программе ЭКО может оказаться достаточным исследование десятка генов с помощью ОТ-ПЦР в режиме реального времени – метода, не уступающего по чувствительности и специфичности микроматричному анализу, но более доступного для рутинного использования.
Цель данной работы состояла в повышении эффективности определения функционального состояния эндометрия периода «окна имплантации» на основе интегральной оценки транскриптов генов как маркеров готовности эндометрия к имплантации эмбриона.
Материал и методы исследования
В исследование включена 71 женщина репродуктивного возраста (до 39 лет) с регулярным менструальным циклом, без патологии эндометрия, с реализованной репродуктивной функцией. Первую группу составили 47 пациенток с трубно-перитонеальным фактором бесплодия, реализовавших репродуктивную функцию в программе ЭКО и обратившихся для проведения повторной программы ЭКО. Вторую группу составили 24 женщины с нормальной репродуктивной функцией, обратившихся с целью подбора средств контрацепции.
Пайпель-биопсия эндометрия выполнялась амбулаторно с помощью аспирационной кюретки «Pipelle de Cornier» (Laboratorie C.C.D., Франция) в естественном менструальном цикле, предшествующем стимуляции суперовуляции. Биоптат эндометрия получали на 7–8-й день после пика лютеинизирующего гормона (ЛГ+7–8), диагностированного по мочевому тесту Clear Blue (Unipath Ltd, Великобритания). Все пациентки подписали информированное согласие на проведение исследования.
Для гистологического исследования биоптаты эндометрия фиксировали в 10% нейтральном формалине в течение 24 часов, после соответствующей стандартной обработки заключали в парафин. Срезы толщиной 5 мкн окрашивали гематоксилином и эозином. Исследование гистологических препаратов проводилось в световом микроскопе при увеличении от х50 до х400.
Определение экспрессии мРНК референсных (B2M, GUSB, TBP) и целевых функциональных генов (глютатион пероксидазы 3 GPX3, прогестаген-ассоциированного эндометриального












