Урология №6 / 2014
Поиск новых режимов антибиотикопрофилактики септических осложнений после перкутанной нефролитотрипсии
1 ФГБУ «НИИ урологии» Минздрава России; 2 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздрава России; 3 ООО «Национальное агентство по клинической фармакологии и фармации», Москва
Риск возникновения инфекционно-воспалительных осложнений после перкутанной нефролитотрипсии обусловлен нахождением микроорганизмов внутри камня в виде биопленки. Разрушение камней во время операции или литотрипсии может явиться пусковым механизмом активации роста микроорганизмов, интегрированных в биопленку, а миграция бактерий и их токсинов в сосудистое русло под давлением ирригационной жидкости может вызывать септические осложнения. Опасность развития инфекционно-воспалительных осложнений при перкутанных вмешательствах по поводу камней почек требует поиска как конкретного антибиотика для антимикробной профилактики, так и эффективных режимов его введения. Представлены результаты сравнительного исследования фармакокинетических показателей ципрофлоксацина, эффективности двух режимов его введения (болюсного и продленного внутривенного) в дозе 1000 мг.
Введение. За последние 20 лет в связи с внедрением в урологическую практику высокотехнологичных вмешательств характер инфекционно-воспалительных осложнений после оперативных вмешательств изменился радикально. Повторные дробления камней в почках, мочеточнике перкутанным, трансуретральным, дистанционным доступами опасны возникновением системного воспалительного ответа с последующим развитием септических осложнений, вплоть до эндотоксического шока.
Известно, что уреазопродуцирующие бактерии, к которым относятся Ureaplasma urealyticum, Proteuss spp., Staphylococcus aureus, Klebsiella spp., Pseudomona spp., являются наиболее значимыми этиологиче- скими факторами, провоцирующими образование «инфекционных» конкрементов. Находясь в чашечках и лоханках, они вызывают нарушение коллоидного равновесия мочи (суперсатурацию) и становятся центром кристаллизации струвитных (MgNH4PO4 6H2O) или карбонатапатитных (Ca10(PO4)6CO3) камней. В ускорении процесса кристаллизации определенную роль играют и входящие в состав клеточной стенки бактерий полисахариды, которые связывают ионы Ca2+ и Mg2+ – компоненты вышеназванных камней [1–3]. Более того, бактерии способны длительно находиться в почечных камнях в составе биопленки. Бактериальные биопленки и механическая травма тканей лоханки камнем являются причиной развития воспалительного процесса в области расположения камня с формированием соединительнотканных спаек, выполняющих функцию отграничения камня от тканей почечной лоханки и одновременно функцию прочной фиксации камня к стенке лоханки.
Разрушение камней во время операции или литотрипсии может являться пусковым механизмом активации роста микроорганизмов, интегрированных в биопленку, а миграция бактерий в сосудистое русло вызывать септические осложнения [4].
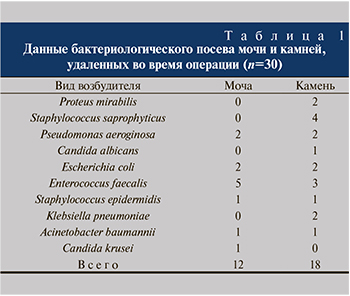
Лечение инфекционно-воспалительных осложнений после дробления таких инфекционных камней затруднено тем, что сведения о возбудителях внутри камня до его дробления отсутствуют, а при назначении антимикробной профилактики руководствуются данными бактериологического исследования мочи, проведенного до оперативного вмешательства. В проведенном нами ранее исследовании [5] показана значительная разница в высеваемости возбудителей из мочи до операции и из камней, удаленных во время дробления, у одного и того же пациента. Частота выделения микроорганизмов из камня значительно выше, чем из мочи: 59,4 против 33,3% соответственно (р<0,001). Отсутствие бактериурии у пациентов с камнями в мочевых путях не отражает наличия микроорганизмов в камне. Кроме того, микроорганизмы в моче и камне могут быть различными.
 Остатки ...
Остатки ...












