Терапия №3 / 2015
Поражения сердца при заболеваниях печени
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», кафедра поликлинической терапии, г. Москва
В работе представлен обзор литературы, освещающий вопросы поражения сердца при циррозах печени различной этиологии (алкогольной, вирусных, болезнях накопления). Рассмотрены патогенез и диагностика цирротической кардиомиопатии. Освещены возможности неинвазивной диагностики фиброза миокарда с использованием сывороточных маркеров фиброза, а также с помощью расчета степени фиброзирования миокарда на основании данных ЭхоКГ и ЭКГ.
Гипердинамический тип кровообращения у больных с циррозом печени (ЦП) был описан Kowalski и соавт. [1] более 50 лет назад. Однако длительное время ЦП не рассматривали как причину кардиальной дисфункции. Описание ряда клинических случаев с летальным исходом вследствие сердечной недостаточности (СН), развившейся вскоре после трансплантации печени или наложения сосудистых шунтов, послужило предпосылкой к детальному изучению патологии сердца при ЦП. Последующие исследования выявили наличие скрытой кардиальной дисфункции у больных с ЦП, независимо от этиологии заболевания. Такая кардиальная дисфункция при отсутствии другой кардиальной патологии получила название цирротической кардиомиопатии (ЦКМ) [2, 3].
ЦКМ характеризуется:
- увеличенным сердечным выбросом в покое;
- сниженным периферическим сосудистым сопротивлением;
- сниженной сократительной способностью миокарда: систолической дисфункцией (СД) в условиях физиологического, физического или фармакологического стресса;
- увеличением толщины левого желудочка (ЛЖ), ассоциированным с диастолической дисфункцией (ДД);
- электрофизиологическими аномалиями [2].
В основе патогенеза СД при ЦКМ лежат нарушение текучести мембран кардиомиоцитов и бета-адренергической передачи, а также активация эндоканнабиноидной системы, оказывающей ингибирующее влияние на сократительную способность миокарда. Сократительную способность кардиомиоцита уменьшают также наблюдаемые при ЦП повышенные уровни эндогенных оксида азота (NO) и монооксида углерода (СО).
Для клинициста важно предвидеть развитие СН (как проявления ЦКМ) после объемных хирургических вмешательств, кровотечений, оперативных пособий: портосистемного шунтирования, в т.ч. трансъягулярного интрапеченочного портосистемного шунтирования (Transjugularis Intrahepatic Portosystemic Shunt, TIPS), трансплантации печени; при развитии инфекционных осложнений [2, 4]. Как в эксперименте, так и в клинических испытаниях показано, что стрессовое воздействие (физическое, фармакологическое) при СД проявляется недостаточным наращиванием сердечного выброса по сравнению со здоровыми добровольцами.
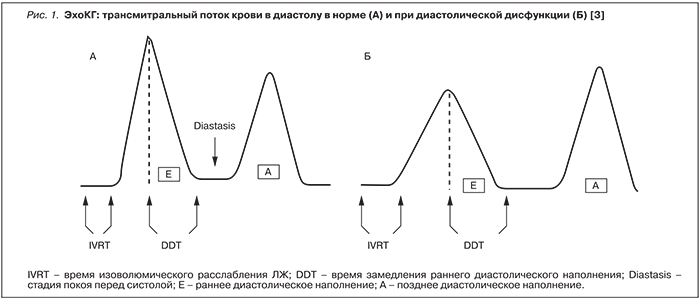
В свою очередь, ДД предположительно развивается вследствие задержки натрия, увеличения объема циркулирующей крови и активации различных нейрогуморальных систем, в т.ч. ренин-ангиотензиновой [2]. ДД миокарда характеризуется аномальным расслаблением во время диастолы, поскольку растяжимость сердечной мышцы снижена вследствие гипертрофии кардиомиоцитов или повышенного отложения интерстициального коллагена. Возросшее сопротивление току крови, заполняющему желудочек, приводит к замедлению заполнения ЛЖ кровью в диастолу. При эхокардиографии (ЭхоКГ) выявляют уменьшение трансмитрального кровотока в раннюю диастолу (величина Е). Компенсаторно увеличивается кровоток в позднюю диастолу, что обусловлено сокращением предсердий (величина А). Таким образом, в отличие от нормы (рис. 1а) у больных с ЦП соотношение величин Е/А уменьшено (рис. 1б) [2, 4].
Электрофизиологические нарушения при ЦП возникают в связи с изменениями клеточных мембран, дефектами на уровне бета-адренорецепторов и пострецепторном пути, дисфункцией ионных каналов. Удлинение QT интервала, предрасполагающее к желудочковым аритмиям и внезапной сердечной смерти, наблюдается примерно у половины больных при ЦП. Увеличенный QT интервал удается нормализовать с помощью бета-блокаторов. Нормализация ЭКГ наблюдается также после трансплантации печени [3, 4]. В патогенезе как СД, так и ДД также играют роль некоторые цитокины (фактор некроза опухолей) и ядерный фактор NF-kВ [2]. Диагностика ЦКМ осуществляется не только с помощью ЭКГ и ЭхоКГ, но и исследованиями различных сывороточных маркеров хронической сердечной недостаточности (ХСН), например, таких как мозговой натрийуретический пептид и N-терминальный фрагмент предшественника мозгового натрий-уретического пептида (NT-proBNP). Имеются сообщения о том, что уровень мозгового натрий-уретического пептида является независимым предиктором среднесрочной (в течение 6 мес) выживаемости при декомпенсированном ЦП и, возможно, может использоваться для стратификации риска у больных с декомпенсированным ЦП [5]. NT-proBNP является надежным неинвазивным маркером ранней дисфункции миокарда на фоне объемной перегрузки камер сердца при прогрессировании портальной гипертензии у больных ЦП.
Наиболее хорошо изученными являются кардиомиопатии при алкогольной болезни печени и болезнях накопления (как наследственных, так и приобретенных).
Кардиомиопатия при алкогольной болезни печени
Известно, что у больных с алкогольной болезнью поражение печени часто сочетается c кардиальной патологией (табл. 1) [6]. Одной из наиболее частых патологий, которую можно рассматривать как внепеченочное проявление, является кардиомиопатия. По частоте кардиальная патология у алкоголиков стоит на третьем...












