Клиническая Нефрология №3-4 / 2016
Посттрансплационные предикторы результатов трансплантации почки
1 ГБУЗ СО «Свердловская областная клиническая больница № 1», Екатеринбург;
2 ФБУН «Екатеринбургский медицинский научный центр профилактики и охраны здоровья рабочих промпредприятий» Роспотребнадзора, Екатеринбург;
3 ФГАОУ ВО «Уральский федеральный университет им. первого Президента России Б.Н. Ельцина», Екатеринбург;
4 ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. академика В.И. Шумакова» МЗ РФ, Москва
Введение
Хроническая болезнь почек (ХБП) – общемировая проблема, связанная со значительной смертностью и заболеваемостью [1, 2]. Распространенность ХБП в общей популяции достигает 10% и более, что связано как с ростом сахарного диабета (СД) 2 типа и артериальной гипертензии (АГ) в развитых странах, так и другой почечной патологии в развивающихся странах [3, 4]. За два последних десятилетия смертность от ХБП повысилась на 82,3% и является третьей среди 25 основных причин смерти по темпам роста после СПИДа и СД [2]. Отмечается неуклонный рост популяции пациентов с терминальной почечной недостаточностью (ТПН), получающих заместительную почечную терапию (ЗПТ) [5].
 Аллотрансплантация почки (АТП) – оптимальный метод заместительной почечной терапии (ЗПТ), т.к. увеличивает продолжительность жизни больных в большей степени, чем перитонеальный и гемодиализ (ГД), обеспечивает более высокое качество жизни и оптимальный уровень медико-социальной реабилитации [6–10]. АТП является, кроме того, наиболее предпочтительным методом ЗПТ с экономической точки зрения [11, 12]. В настоящее время в мире ежегодно выполняют около 70 тыс. трансплантаций почки, при этом 5-летняя выживаемость больных и ренальных аллотрансплантатов (РАТ) достигает 80% и более [13, 14]. В то же время успехи клинической нефротрансплантологии относятся преимущественно к первым годам после операции, тогда как потери ренальных аллотрансплантатов (РАТ) в отдаленном периоде остаются значительными. По данным международных регистров доля таких потерь к 5 годам после АТП составляет 25–30%, а к 10–15 годам она возрастает почти до 50% [13–15]. Исследуются многие группы факторов, являющихся предиктором отдаленных результатов трансплантации почки: иммунологическая совместимость, тип донора и биологическое состояние донорского органа, возраст донора и реципиента, длительность периода консервации, коморбидная патология реципиента, инфекционные осложнения и др. [8, 9, 16, 17].
Аллотрансплантация почки (АТП) – оптимальный метод заместительной почечной терапии (ЗПТ), т.к. увеличивает продолжительность жизни больных в большей степени, чем перитонеальный и гемодиализ (ГД), обеспечивает более высокое качество жизни и оптимальный уровень медико-социальной реабилитации [6–10]. АТП является, кроме того, наиболее предпочтительным методом ЗПТ с экономической точки зрения [11, 12]. В настоящее время в мире ежегодно выполняют около 70 тыс. трансплантаций почки, при этом 5-летняя выживаемость больных и ренальных аллотрансплантатов (РАТ) достигает 80% и более [13, 14]. В то же время успехи клинической нефротрансплантологии относятся преимущественно к первым годам после операции, тогда как потери ренальных аллотрансплантатов (РАТ) в отдаленном периоде остаются значительными. По данным международных регистров доля таких потерь к 5 годам после АТП составляет 25–30%, а к 10–15 годам она возрастает почти до 50% [13–15]. Исследуются многие группы факторов, являющихся предиктором отдаленных результатов трансплантации почки: иммунологическая совместимость, тип донора и биологическое состояние донорского органа, возраст донора и реципиента, длительность периода консервации, коморбидная патология реципиента, инфекционные осложнения и др. [8, 9, 16, 17].
Целью настоящего исследования явилось изучение ряда посттрансплантационных предикторов исходов АТП.
Материал и методы
В исследование включены 350 пациентов, перенесших трансплантацию почки по поводу ТПН. Максимальный срок наблюдения после АТП достиг 352 месяца (29,3 года); средний срок наблюдения – 79,1±3,4, медиана – 68, стандартное отклонение (СО) – 6,9 месяца. Наблюдались 229 (65,4%) мужчин, женщин – 121 (34,6%). Возраст пациентов составил в среднем 37,1±0,6 года (12–61 лет, СО – 10,4, медиана – 38 лет).
Структура нозологических форм, приведших к ТПН, была следующей. Хронический гломерулонефрит диагностирован у 199 (50,9%) больных, врожденные заболевания почек и мочевыводящих путей – у 23 (5,9%), хронические тубулоинтерстициальные заболевания – у 17 (4,3%) больных. Диабетическая нефропатия (ДН) выявлена у 11 (2,8%) больных. Другие заболевания почек констатированы у 10 (2,6%) пациентов. Диагноз основного заболевания не был уточнен у 90 (23%) больных.
Средняя продолжительность диализа до АТП составила 26,6±1,3 месяца, СО – 21,3; максимум – 162 месяца (13,5 лет). Пять (1,43%) пациентов перенесли упреждающую трансплантацию почки. Трансплантаций с использованием трупного донора было выполнено 342 (97,7%), от живых родственных доноров – 8 (2,29%). Первичных АТП было 338 (96,6%), повторных – 12 (3,7%).

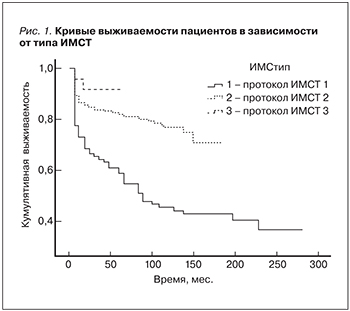
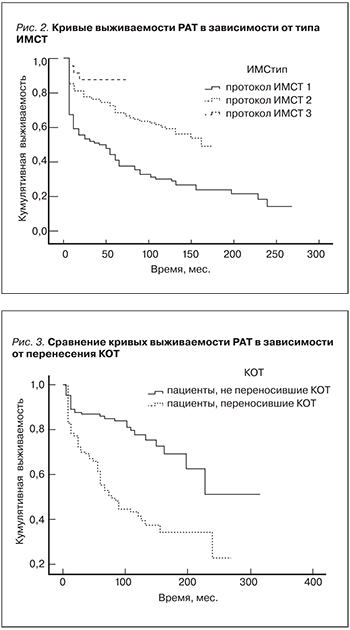
Использовано три протокола иммуносупрессивной терапии (ИМСТ): 1 – циклоспорин+преднизолон+азатиоприн (96 пациентов – 27,5%); 2 – циклоспорин+преднизолон+микофенолат (228 пациентов – 65,1%); 3 – такролимус+преднизолон+микофенолат (26 пациентов – 7,4%). В качестве индукционной ИМСТ в отношении 174 (44,5%) пациентов применялись блокаторы рецепторов интерлейкина-2 (БРИ): базиликсимаб – «Новартис Фарма», Швейцария, и даклизумаб – «Ф. Хоффманн-Ля Рош. Лтд.», Швейцария. Уровень циклоспорина-А (ЦсА) в крови измерен методом радиоиммунного анализа и флюоресцентного поляризационного иммуноанализа (Abbott TDX). Для определения концентрации такролимуса (Так) и ЦсА в крови использована также иммунохимическая методика (иммунохимический анализатор Архитект i2000 sr). Исследовалась концентрация ЦсА до утреннего приема препарата (С0-уровень) либо через 2 часа после утреннего приема (С2-уровень).
В ряде случаев изучен профиль фармококинетики препарата в период абсорбции (С0–С4-уровни) [18–22]. Концентрацию Так измеряли по С0-уровню препарата в крови [22, 23].
 Часть (208 человек – 59,4%) пациентов получала противовирусную терапию препаратами ганцикловир («Ф. Хоффманн-Ля Рош. Лтд.», Швейцария) и валганцикловир («Ф. Хоффманн-Ля Рош. Лтд., Швейцария) либо в качестве профилактики цитомегаловирусной инфекции (ЦМВ) – профилактическая противовирусная терапия (ППВТ), либо в качестве лечения манифестных форм ЦМВ-инфекции.
Часть (208 человек – 59,4%) пациентов получала противовирусную терапию препаратами ганцикловир («Ф. Хоффманн-Ля Рош. Лтд.», Швейцария) и валганцикловир («Ф. Хоффманн-Ля Рош. Лтд., Швейцария) либо в качестве профилактики цитомегаловирусной инфекции (ЦМВ) – профилактическая противовирусная терапия (ППВТ), либо в качестве лечения манифестных форм ЦМВ-инфекции.
Дисфункцию трансплантата констатир...












