Кардиология №6 / 2016
Повышенная концентрация липопротеида(а) и наличие подфракций мелких плотных липопротеидов низкой плотности как независимые факторы риска ишемической болезни сердца
ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
Повышенный уровень холестерина (ХС) липопротеидов низкой плотности (ЛНП) — один из основных факторов риска (ФР) развития атеросклероза и ишемической болезни сердца (ИБС). Согласно последним рекомендациям, уровень ХС ЛНП у пациентов из группы повышенного риска не должен превышать 2,6 ммоль/л, а в некоторых случаях и 1,8 ммоль/л, что достигается с помощью агрессивной гиполипидемической терапии. Однако известно, что ЛНП представляют собой очень гетерогенную популяцию частиц, различающихся по своим физико-химическим свойствам [1].
Липопротеид(а) [Лп(а)] представляет собой сложный надмолекулярный комплекс, состоящий из ЛНП-подобной частицы, в которой молекула белка апоВ100 связана дисульфидной связью с молекулой сильно гликозилированного апобелка(а) [апо(а)]. Согласно многочисленным исследованиям, Лп(а) является независимым ФР возникновения и развития атеросклероза, ИБС и их осложнений [2]. В настоящее время нет ясного представления о метаболизме Лп(а), и в частности, понимания того, как происходит сборка частицы и какие ЛНП участвуют в этом процессе. Предполагают, что сборка Лп(а) может происходить внутриклеточно, на поверхности гепатоцитов или внеклеточно непосредственно в крови человека [3—6].
 Известно, что наиболее атерогенными являются мелкие плотные частицы ЛНП [7]; напротив, крупные частицы ЛНП присутствуют у пациентов без клинически значимого поражения коронарного русла [8]. Механизм высокой атерогенности Лп(а) также до конца неясен, несмотря на интенсивные исследования. Данные о связи Лп(а) с подфракциями других апоВ-содержащих липопротеидов, а также об их сочетанном влиянии на развитие атеросклероза и ИБС крайне ограничены [9, 10].
Известно, что наиболее атерогенными являются мелкие плотные частицы ЛНП [7]; напротив, крупные частицы ЛНП присутствуют у пациентов без клинически значимого поражения коронарного русла [8]. Механизм высокой атерогенности Лп(а) также до конца неясен, несмотря на интенсивные исследования. Данные о связи Лп(а) с подфракциями других апоВ-содержащих липопротеидов, а также об их сочетанном влиянии на развитие атеросклероза и ИБС крайне ограничены [9, 10].
Уровень Лп(а) в плазме крови контролируется генетически и устойчив к медикаментозной терапии, являясь одной из наиболее вероятных причин резидуального риска развития осложнений у пациентов, получающих оптимальную терапию статинами. Кроме того, существующая в настоящее время в клинической практике оценка ХС ЛНП не учитывает вклада Лп(а), что вносит достоверную погрешность в адекватную оценку этих параметров [11]. Таким образом, изучение связи Лп(а) с подфракциями апоВ-содержащих липопротеидов и их совместного влияния на риск развития ИБС представляется актуальной задачей.
Цель исследования: изучить взаимосвязь Лп(а) и под-фракционного состава апоВ-содержащих липопротеидов с наличием ИБС.
Материал и методы
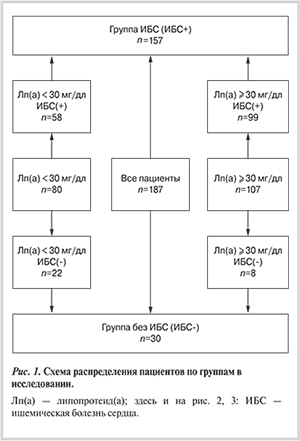
В исследование были включены 187 пациентов (средний возраст 58±9 лет), имеющих не менее одного ФР развития ИБС с уровнем Лп(а) не менее 3 мг/дл. Исходя из цели работы — изучить взаимосвязь Лп(а), подфракций атерогенных липопротеидов и наличия ИБС — в исследование были включены пациенты с условно нормальным (не более 30 мг/дл) и повышенным (более 30 мг/дл) уровнем Лп(а), таким образом, чтобы число лиц в группах было сопоставимо (рис. 1). Были включены мужчины (n=141; средний возраст 57±9 лет) и женщины (n=46; средний возраст 60±9 лет). Уровни общего холестерина (ОХС), триглицеридов (ТГ), ХС липопротеидов высокой плотности (ЛВП) в сыворотке крови определяли ферментативным колориметрическим методом коммерческими наборами «Biocon» (Германия). Содержание ХС ЛНП рассчитывали по формуле Фридвальда: ХС ЛНП = ОХС – ХС ЛВП – ТГ/2,2 (ммоль/л), корригированный уровень ХС ЛНП, учитывающий вклад ХС Лп(а): ХС ЛНПкорр = ХС ЛНП – 0,3×Лп(а)/38,5, где Лп(а) — концентрация Лп(а) в миллиграммах на децилитр [12]. Концентрацию Лп(а) во всех исследуемых образцах измеряли при помощи иммуноферментного анализа с использованием поликлональных антител к Лп(а) [13]. Метод был валидирован относительно коммерческих наборов (Immunozym Lp(a) и (TintElizeTM Lp(a). В качестве референсного стандарта использовали контрольный препарат Лп(а) (Technoclone), одобренный Международной Федерацией клинической химии.
Количественное содержание подфракций липопротеидов определяли с помощью системы (Lipoprint Quantimetrix). При этом образцы сыворотки крови больных для анализа хранили при температуре –70 °С, не допуская повторных циклов замораживания—оттаивания. Данные выражали как концентрацию (мг/дл) ХС в различных подфракциях липопротеидов [14].
Коронарографию проводили в лаборатории рентгенэндоваскулярных методов диагностики и лечения в амбулаторных условиях при научно-диспансерном отделе Института клинической кардиологии им. А.Л. Мясникова. Количественный анализ ангиограмм осуществляли с помощью интегрированной компьютерной программы Philips Medical Systems. Коронарный атеросклероз подтверждали при наличии стеноза более 50% по диаметру, по крайней мере, в одной магистральной артерии.












