Акушерство и Гинекология №2 / 2018
Предикторы эффективности спонтанного хетчинга бластоцист человека в программах вспомогательных репродуктивных технологий
1 ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва;
2 Московский государственный университет им. М.В. Ломоносова, Россия
Неспособность бластоцист человека к спонтанному хетчингу в программах вспомогательных репродуктивных технологий (ВРТ) может приводить к неудачам имплантации и отсутствию беременности. Механизм спонтанного хетчинга и предикторы его эффективности известны не в полной мере и требуют дальнейшего изучения.
Цель исследования. Изучить роль клеточных, генетических, клинико-лабораторных и ятрогенных факторов в эффективности спонтанного хетчинга бластоцист человека в программах ВРТ.
Материал и методы. В исследование были включены 83 бластоцисты человека, донированные для научных исследований. Оценку степени зрелости, качества ооцитов и эмбрионов, толщины блестящей оболочки, выявление дисморфизмов ооцитов и мониторинг хетчинга проводили с применением световой микроскопии. Оценку экспрессии мРНК генов CTSL-2, GATA3 и CGB осуществляли методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ).
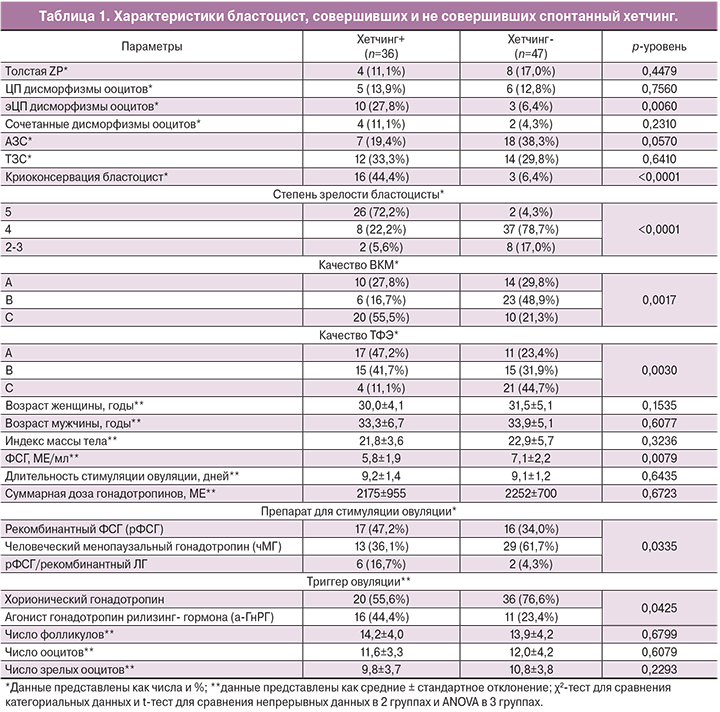
Результаты. Состояние блестящей оболочки и качество гамет, из которых были получены бластоцисты, не оказывали значимого влияния на хетчинг, за исключением экстрацитоплазматических дисморфизмов ооцитов, при наличии которых эффективность хетчинга увеличивалась в 4,3 раза. Все три составляющие оценки бластоцист по шкале Гарднера были значимо выше в группе эффективного хетчинга. На успех хетчинга оказывал влияние более низкий уровень ФСГ, а также стимуляция суперовуляции с рекомбинантным ФСГ и назначение в качестве триггера овуляции агониста гонадотропин-рилизинг-гормона (а-ГнРГ).
В группе бластоцист с эффективным хетчингом отмечалась более высокая экспрессия мРНК генов CTSL2, GATA3 и CGB. Степень зрелости и качество эмбрионов были связаны с экспрессией мРНК генов CTSL2 и GATA3, которая была выше у эмбрионов 5–6-й степени зрелости и эмбрионов класса А.
Заключение. Основное влияние на эффективность спонтанного хетчинга бластоцист человека оказывают не качество блестящей оболочка и гамет, а качество самих бластоцист. Бластоциста может моделировать свою дальнейшую судьбу при помощи собственных генетических факторов. Экспрессия мРНК генов CTSL2, GATA3 и CGB является более высокой у бластоцист лучшего качества, что позволяет им совершить спонтанный хетчинг. Определенную роль в эффективности хетчинга играет выбор протокола стимуляции суперовуляции.
Одной из важных задач вспомогательных репродуктивных технологий (ВРТ) является повышение вероятности наступления беременности при селективном переносе одного эмбриона [1]. По данным J. Gunbi и соавт. [2], только треть циклов ВРТ приводит к развитию беременности и около четверти из них – к рождению ребенка. Наступление беременности во многом зависит от трех составляющих: рецептивности эндометрия, функционально полноценного эмбриона, способного к имплантации, и доставки эмбриона к зоне имплантации [3].
Таким образом, особенно важной становится задача выбора эмбриона для переноса. Для обоснованного выбора эмбриона необходимо выявление и изучение предикторов эффективности его дальнейшего развития in vitro и, после переноса, in vivo.
В первые 5–6 суток преимплантационного развития эмбрион человека находится внутри блестящей оболочки (англ. – zona pellucida, ZP) [4]. Доказано, что ZP играет важную роль во время оплодотворения и преимплантационного развития эмбриона [5]. Выход эмбриона из ZP обозначается термином хетчинг [6]. Хетчинг обусловлен механическими периодическими сокращениями и набуханиями бластоцисты, в генезе которых важную роль играют лизирующие факторы, выделяемые бластоцистой и эндометрием [7, 8].
По данным, полученным in vitro, до 75% всех морфологически нормальных бластоцист человека не способны к самостоятельному выходу из ZP [9]. Отсутствие спонтанного хетчинга может являться одной из важных причин привычной неудачи имплантации [10], а определение факторов риска позволит определить показания для проведения процедуры вспомогательного хетчинга [11]. Несмотря на большое число исследований, проведенных на животных моделях, а также широкое распространение методов ВРТ, биомеханические и молекулярные механизмы хетчинга до сих пор неизвестны в полной мере и требуют дальнейшего изучения.
Цель исследования: изучить роль клеточных, генетических, клинико-лабораторных и ятрогенных факторов в эффективности спонтанного хетчинга бластоцист человека в программах ВРТ.
Материал и методы исследования
Для проведения исследования были изучены 83 бластоцисты. Отбор бластоцист осуществлялся в отделении вспомогательных технологий в лечении бесплодия среди супружеских пар, обратившихся по поводу проведения программы ВРТ и донировавших бластоцисты для научных исследований. Критериями включения в исследование были нормальный кариотип супружеских пар, донировавших эмбрионы и подписавших информированное согласие на участие в исследовании. Критериями исключения были: остановка эмбриона в развитии до 5-х суток культивирования, дегенеративные изменения в бластоцистах и проведение вспомогательного хетчинга исследуемых эмбрионов.
Полученные ооциты отмывали от фолликулярной жидкости и крови и инкубировали в культуральной среде в течение 2–3 часов, после чего производили денудирование ооцитов. Оценку степени зрелости, качества ооцитов и эмбрионов, толщины блестящей оболочки, выявление дисморфизмов ооцитов и мониторинг хетчинга проводили при помощи световой микроскопии (Nikon TE 300, общее увеличение х400). Оценку успеха самостоятельного хетчинга проводили через 144–146 часов после оплодотворения [12]. Анализ эякулята проводили согласно рекомендациям ВОЗ 2010 года [13].
Исследование экспрессии мРНК генов катепсина L2 (CTSL2), активатора транскрипции GATA3 и хорионического гонадотропина (CGB) осуществляли методом полимеразной цепной реакции в реальном времени с предварительной обратной транскрипцией (ООО «НПО ДНК-Технология», Россия).
Статистическую обработку данных выполняли при помощи пакета программ Statistica V10 (США) с применением χ2-теста для оценки часто...












