Акушерство и Гинекология №9 / 2021
Пренатальная ультразвуковая диагностика и исходы врожденных пороков легкого у плода. Опыт Центра за 10-летний период: 363 наблюдения
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия
Цель: Анализ возможности пренатальной ультразвуковой диагностики и оценка исходов у плодов
с врожденными пороками легких.
Материалы и методы: С 2010 по 2019 гг. на консилиум в Центр обратились 363 беременные с пренатально выявленными пороками легких у плода.
Результаты: Наиболее часто пороки легких диагностированы в сроках 20–22 недели гестации (96,7%). При эхографии основными признаками заболевания являлись повышение эхогенности легочной ткани (100%), увеличение в размерах патологического легкого, наличие кист (71,9%), смещение средостения в контралатеральную сторону. При динамическом наблюдении положительная динамика течения заболевания установлена в 77,7% наблюдений, из них в 12,3% отмечено полное исчезновение ранее выявляемых признаков, отсутствие изменений отмечено в 18,2%. Водянка плода выявлена у 4,4% плодов. Родоразрешение в Центре проведено у 271 беременной, родился живым 271 ребенок. Точность ультразвуковой диагностики пороков легких составила 92,6%. Хирургическое лечение проведено 84,9% новорожденным, послеоперационная летальность составила 0,5% (1 недоношенный новорожденный).
Заключение: Применение эхографии позволяет с высокой точностью диагностировать внутриутробно пороки развития легких. Общая летальность плодов и детей с данной патологией с учетом внутриутробной и постнатальной составила 4,7%, из них 4,4% – дооперационная и 0,3% – послеоперационная.
Кистозно-аденоматозная мальформация легких (КАМЛ) и легочная секвестрация (ЛС) являются наиболее частыми врожденными пороками развития легких плода и новорожденного. КАМЛ возникает в результате нарушения формирования терминальных бронхиол с образованием в ткани легкого различного диаметра кист [1–4]. ЛС – это участок аномально развитой легочной паренхимы, не связанный напрямую с воздухоносными путями, его кровоснабжение осуществляется по аномальным сосудам из системного кровотока – аорты и ее ветвей [3–5].
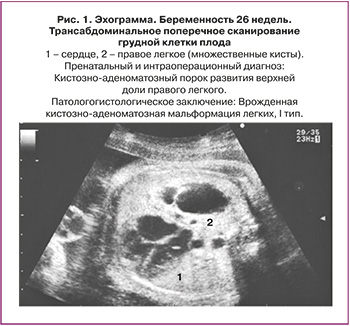 Частота встречаемости КАМЛ широко варьирует, от 1:2000–3000 до 1:35 000 к общему числу новорожденных [6–10]. Частота встречаемости ЛС точно неизвестна, что связано с относительной редкостью данного заболевания [5].
Частота встречаемости КАМЛ широко варьирует, от 1:2000–3000 до 1:35 000 к общему числу новорожденных [6–10]. Частота встречаемости ЛС точно неизвестна, что связано с относительной редкостью данного заболевания [5].
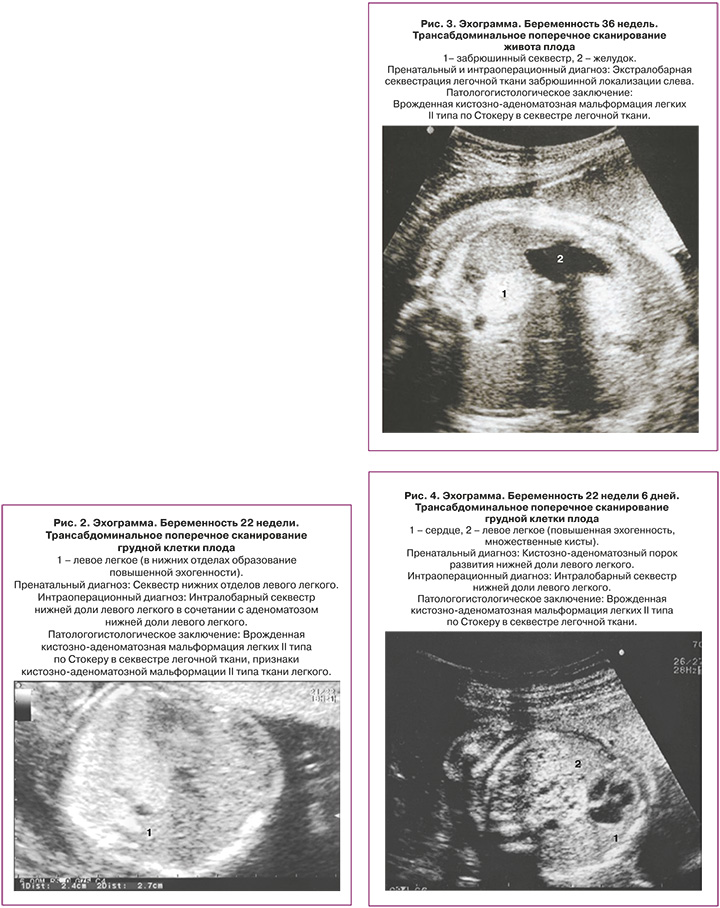
Морфологическая классификация КАМЛ, предложенная J. Stocker, основана на размере кист и характере выстилающего их эпителия. Она одинаково удобна для описания как поражения собственно легочной ткани, так и секвестров легкого: I тип – большие кисты 2–10 см в диаметре, выстланные многослойным эпителием, II тип – кисты 0,5–2 см, выстланные цилиндрическим эпителием, III тип – микрокисты, менее 0,5 см в диаметре, выстланные кубическим эпителием. Впоследствии к этой оригинальной классификации было добавлено еще два типа: 0 тип – солидная ткань и IV тип – одна большая киста. Эти два типа составляют всего 5% всех кистозно-аденоматозных пороков развития легкого (КАПРЛ) [11]. В настоящее время существует мнение, что КАМЛ и ЛС нельзя всегда рассматривать как самостоятельные нозологические единицы. Морфологические исследования свидетельствуют о том, что около 50% КАМЛ и ЛС являются «гибридными формами», имеющими как признаки аномального строения ткани собственно легкого, так и характерные для секвестрации особенности кровоснабжения патологического участка [3, 11–14]. В целом происхождение, морфологические особенности и клинические данные этих заболеваний очень схожи, что позволяет объединить их в группу КАПРЛ (рис. 1–4).
Сопутствующая патология при КАПРЛ выявляется в 3–22% случаев. Наиболее часто это аномалии сердечно-сосудистой и мочевыделительной системы, врожденная диафрагмальная грыжа (ВДГ) [1, 8, 11, 12, 15]. Хромосомная патология встречается крайне редко [8].
Классификация ЛС основана на локализации и связи с долей легкого. Интралобарный секвестр располагается в пределах доли легкого, они покрыты единым листком плевры, часто отсутствует четкая граница между тканью секвестра и нормальной легочной паренхимой. Экстралобарный секвестр полностью отделен от легкого и имеет собственную плевру, может располагаться в плевральной полости или в поддиафрагмальном пространстве, обычно ретроперитонеально [5].
Пренатальная диагностика аномалий легочной ткани в основном возможна с 20–21-й недели беременности [1, 3, 8, 11, 16]. При эхографии в грудной клетке плода определяется увеличение размеров и повышение эхогенности всего легкого или его части с наличием или отсутствием в нем кистозных включений. В подавляющем числе наблюдений изменениям подвергается одна из долей легкого, и процесс имеет одностороннюю локализацию (более чем в 95% случаев) [1, 3, 8, 11]. В 26–28 недель беременности наблюдается пик роста легочной патологии [1, 8]. В дальнейшем, обычно после 32 недель, может происходить уменьшение размера или полное исчезновение внутриутробных эхографических признаков данной патологии [4, 6, 9, 12, 17–20].
Исходы для новорожденного расцениваются как благоприятные в случае неосложненного внутриутробного течения заболевания. Выживаемость новорожденных составляет 88–97% [8, 11, 12]. Неблагоприятным вариантом течения беременности при легочной мальформации является развитие водянки плода [1, 2, 11]. Во внутриутробном периоде появление данного осложнения при пороках легкого отмечено в 5–9% наблюдений [8, 12], что значительно ниже, чем в популяции. По данным литературы, частота встречаемости неиммунной водянки плода составляет 1 на 3000–4000 новорожденных [20–22]. При консервативной тактике ведения беременности при водянке плода частота летального исхода варьирует в пределах 50–100% [11, 12]. В настоящее время при развитии данного осложнения внутриутробно у плода с пороком легкого возможно проведение хирургического лечения: при наличии крупных кистозных полостей – торакоамниотическое шунтирование [8, 12], склеротерапия [23], при ЛС – внутриутробная лазерная коагуляция питающего сосуда [12].
Как уже отмечалось ранее, в процессе прогрессирования беременности к окончанию III триместра в 15–50% случаев происходит исчезновение патологических признаков рассматриваемой патологии [1, 8, 11, 12]. Однако после обследования новорожденных (КТ или МРТ с контрастированием сосудов) «исчезнувшая» патология вновь обнаруживается в 60–100% случаев [6, 11, 12]. При этом авторы отмечают низкую диагностическую точность рентгенографии (около 60%) по сравнению с КТ.
Тактика ведения беременности при патологии легких зависит от размеров образования. Большие размеры образования и смещение средостения требуют родоразре...












